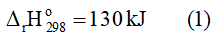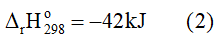Câu hỏi:
191 lượt xemCâu hỏi 10 trang 14 Hóa học 11: Cho các cân bằng sau:
a) 2SO2(g) + O2(g) ⇌ 2SO3(g)
b) CO(g) + H2O(g) ⇌ H2(g) + CO2(g)
c) PCl5(g) ⇌ Cl2(g) + PCl3(g)
d) H2(g) + I2(g) ⇌ 2HI(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích.
Lời giải
Hướng dẫn giải:
a) 2SO2(g) + O2(g) ⇌ 2SO3(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ chuyển dịch theo chiều thuận, tức chiều làm giảm áp suất (hay chiều làm giảm số mol khí).
b) CO(g) + H2O(g) ⇌ H2(g) + CO2(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ không chuyển dịch, do đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ.
c) PCl5(g) ⇌ Cl2(g) + PCl3(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ chuyển dịch theo chiều nghịch, tức chiều làm giảm áp suất (hay chiều làm giảm số mol khí).
d) H2(g) + I2(g) ⇌ 2HI(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ không chuyển dịch, do đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ.