(2023) Đề thi thử Hóa học Liên trường THPT Hà Nội có đáp án
- 1Làm xong biết đáp án, phương pháp giải chi tiết.
- 2Học sinh có thể hỏi và trao đổi lại nếu không hiểu.
- 3Xem lại lý thuyết, lưu bài tập và note lại các chú ý
- 4Biết điểm yếu và có hướng giải pháp cải thiện
Kim loại Fe tác dụng với dung dịch axit nào sau đây giải phóng khí H2?
Kim loại nào sau đây tác dụng mạnh với nước ở điều kiện thường
Chất rắn X dạng sợi, màu trắng, không tan trong nước ngay cả khi đun nóng. Thủy phân hoàn toàn X nhờ xúc tác axit hoặc enzim thu được chất Y. Nhận định nào sau đây là đúng?
Cho 0,15 mol Gly-Glu tác dụng với dung dịch KOH dư, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, số mol KOH đã phản ứng là
Cho các polime: poli(butađien-stiren), poliacrilonitrin, polibutađien, poliisopren, poli(butađien-acrilonitrin), poli(etylen-terephtalat). Số polime dùng làm cao su là
A. 5
B. 3
C. 4
D. 2
Cho sơ đồ các phản ứng xảy ra ở nhiệt độ thường:
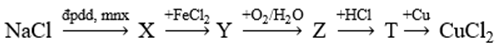
Hai chất X, T lần lượt là :
Thủy phân hoàn toàn 8,8 gam 1 este đơn chức X mạch hở cần dùng vừa đủ 100ml dung dịch NaOH 1M, thu được 9,6 gam muối Y và ancol Z. Công thức cấu tạo của X là
Hòa tan hết 8,4 gam Fe trong dung dịch H2SO4 đặc nóng (dư), thu được V lít khí SO2 (đktc, là sản phẩm khử duy nhất của S+6). Giá trị của V là
Isoamyl axetat là este có mùi thơm của chuối chín. Công thức cấu tạo của isoamyl axetat là
Công thức nào dưới đây là công thức của chất béo?
Chất nào sau đây thuộc loại polisaccarit
Amin nào dưới đây là amin bậc 2?
Trường hợp nào sau đây xảy ra ăn mòn điện hoá?
Kim loại nào có nhiệt độ nóng chảy cao nhất?
Chất nào dưới dây là chất điện li mạnh ?
Tơ nitron thuộc loại tơ vinylic có đặc tính dai, bền với nhiệt và giữ nhiệt tốt. Tơ nitron được tổng hợp bằng phản ứng :
X là oxit axit có màu đỏ thẫm và có tính oxi hóa mạnh. Vậy X là
Glixerol là sản phẩm của phản ứng xà phòng hoá chất béo. Công thức hóa học của glixerol là
Sắt tác dụng với lượng dư chất nào sau đây tạo hợp chất sắt (II)?
Phương pháp thích hợp điều chế kim loại Ca từ CaCl2 là
Nước thải công nghiệp chế biến cafe, chế biến giấy… chứa hàm lượng chất hữu cơ cao ở dạng hạt lơ lửng. Trong quá trình xử lý loại nước thải này, để làm cho các hạt lơ lửng này keo tụ lại thành khối lớn, dễ dàng tách ra khỏi nước (làm trong nước) người ta thêm vào nước thải một lượng
X là kim loại kiềm thuộc chu kì 3. X là
Cho este X có công thức phân tử là C4H8O2 tác dụng với dung dịch NaOH đun nóng thu được muối Y có phân tử khối lớn hơn phân tử khối của X. Tên gọi của X là
Chất không tan trong dung dịch HCl là:
Loại than có khả năng hấp phụ mạnh, được dùng nhiều trong mặt nạ phòng độc, trong công nghiệp hoá chất và trong y học gọi là :
Cho các phát biểu sau:
(a) Trong công nghiệp, kim loại Al được điều chế bằng cách điện phân AlCl3 nóng chảy.
(b) Trong tự nhiên, các kim loại kiềm chỉ tồn tại ở dạng hợp chất.
(c) Hợp chất NaHCO3 có tính chất lưỡng tính.
(d) Muối Ca(HCO3)2 kém bền với nhiệt.
Số phát biểu đúng là
A. 5
B. 3
C. 4
D. 2
Glyxin (H2N-CH2-COOH) không tác dụng với dung dịch nào sau đây?
Cho các phát biểu sau:
(a) Xenlulozơ trinitrat là nguyên liệu để sản xuất tơ nhân tạo.
(b) Đipeptit Gly-Ala có phản ứng màu biure.
(c) Thủy phân vinyl fomat thu được hai sản phẩm đều có phản ứng tráng bạc.
(d) Phenylamin tan ít trong nước, nhưng tan tốt trong dung dịch HCl.
(e) Tinh bột là đồng phân của xenlulozơ.
Số phát biểu sai là :
A. 4
B. 2
C. 3
D. 5
Trường hợp nào sau đây không xảy ra phản ứng?
Chất nào sau đây được dùng để làm mềm nước có tính cứng toàn phần?
Hỗn hợp khí X gồm C2H4, C2H2, C3H8, C4H10. Lấy 6,32 gam X cho qua bình đựng nước Br2 (dư) thấy có 0,12 mol Br2 tham gia phản ứng. Mặt khác, đốt cháy hết 2,24 lít X (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được 9,68 gam CO2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
Khi lên men m gam glucozơ thì thu được C2H5OH và khí CO2. Hấp thụ toàn bộ lượng khí này vào 50 gam dung dịch NaOH 16%, thu được dung dịch chứa 13,7 gam muối (không có kiềm dư). Mặt khác, 2m gam glucozơ tác dụng hết với lượng dư dung dịch AgNO3 trong NH3, thu được 0,4 mol Ag. Hiệu suất của quá trình lên men là
Hỗn hợp X gồm axit oleic, axit stearic và triglixerit Y. Đốt cháy hoàn toàn m gam hỗn hợp X cần vừa đủ 71,792 lit khí O2 (đo ở đktc) thu được 2,25 mol CO2. Mặt khác m gam hỗn hợp X làm mất màu vừa đủ 6,4 gam brom trong CCl4. Nếu cho m gam hỗn hợp X phản ứng với dung dịch NaOH đun nóng (vừa đủ) thu glixerol và dung dịch chứa hai muối. Phần trăm khối lượng của Y trong m gam hỗn hợp X là
Hòa tan hết 31,36 gam hỗn hợp rắn X gồm Mg, Fe, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 46,54 gam kết tủa và 0,56 lít khí (đktc). Nếu cho Z tác dụng với dung dịch BaCl2 dư thì thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Fe3O4 trong X là
Hỗn hợp X gồm triglixerit Y và axit béo Z. Cho m gam X phản ứng hoàn toàn với dung dịch NaOH dư, thu được sản phẩm hữu cơ gồm một muối và 1,84 gam glixerol. Nếu đốt cháy hết m gam X thì cần vừa đủ 2,57 mol O2, thu được 1,86 mol CO2 và 1,62 mol H2O. Khối lượng của Z trong m gam X là
Đốt cháy 5 gam kim loại kiềm M với oxi, sau khi oxi hết thu được 9,8 gam hỗn hợp gồm oxit và M dư. Phần trăm khối lượng M bị oxi hóa là
Tiến hành điện phân dung dịch chứa m gam hỗn hợp muối CuSO4 và NaCl bằng dòng điện một chiều có cường độ 2A (với điện cực trơ, có màng ngăn xốp). Kết quả thí nghiệm được ghi trong bảng sau:
|
Thời gian điện phân (giây) |
t |
t + 3377,5 |
2t |
|
Lượng khí sinh ra từ bình điện phân (mol) |
x |
x + 0,035 |
2,0625x |
|
Lượng kim loại Cu sinh ra ở catot (mol) |
y |
y + 0,025 |
y + 0,025 |
Giả sử hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m gần nhất với:
Có hỗn hợp FeO + Al2O3 được chia thành 2 phần bằng nhau:
Phần 1: Tan vừa đủ trong dung dịch có 0,9 mol HCl
Phần 2: Đem nung nóng rồi thổi H2 qua, sau một thời gian được 20,2 gam hỗn hợp gồm ba chất rắn và sinh ra 0,9 gam nước.
Phần trăm khối lượng Al2O3 trong hỗn hợp ban đầu là
Cho 100 ml dung dịch H3PO4 vào 100 ml dung dịch NaOH 2,5M thu được dung dịch chứa 20,2 gam hỗn hợp muối. Nồng độ mol/l của dung dịch H3PO4 là
Cho E, Z, F, T đều là các hợp chất hữu cơ no, mạch hở và thỏa mãn sơ đồ các phản ứng:
E + NaOH → X + Y + Z
X + HCl → F + NaCl
Y + HCl → T + NaCl
Biết: E chỉ chứa nhóm chức este và trong phân tử có số nguyên tử cacbon bằng số nguyên tử oxi; ME < 168; MZ < MF < MT.
Cho các phát biểu sau:
(a) Có hai công thức cấu tạo của E thỏa mãn sơ đồ trên.
(b) Trong phân tử Z và T đều không có liên kết pi.
(c) Chất F được dùng để điều chế khí CO trong phòng thí nghiệm.
(d) 1 mol chất T phản ứng với kim loại Na thu được tối đa 1 mol H2.
(e) Nhiệt độ sôi của F cao hơn nhiệt độ sôi của Z.
(f) T là hợp chất hữu cơ đơn chức.
Số phát biểu đúng là
A. 1
B. 4
C. 3
D. 2