(2023) Đề thi thử Hóa THPT theo đề minh họa của Bộ Giáo dục có đáp án (Đề 36)
- 1Làm xong biết đáp án, phương pháp giải chi tiết.
- 2Học sinh có thể hỏi và trao đổi lại nếu không hiểu.
- 3Xem lại lý thuyết, lưu bài tập và note lại các chú ý
- 4Biết điểm yếu và có hướng giải pháp cải thiện
Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là
Hợp chất nào sau đây không có tính lưỡng tính?
Alanin có công thức là
Khi nói về kim loại, phát biểu nào sau đây sai?
Kim loại nào sau đây thuộc nhóm IIA trong bảng tuần hoàn?
Dung dịch NaOH có phản ứng với dung dịch
Cặp chất nào sau đây gây nên tính cứng tạm thời của nước?
Chất X có cấu tạo CH3CH2COOCH3. Tên gọi của X là
Trường hợp nào sau đây xảy ra ăn mòn điện hóa học?
PE là polime có nhiều ứng dụng rộng rãi (dùng làm áo mưa, khăn trải bàn, túi ni-lông). Có thể điều chế PE bằng phản ứng trùng hợp monome nào sau đây?l.
Trường hợp nào sau đây các ion không cùng tồn tại trong một dung dịch?
Có thể sử dụng bình bằng nhôm để chuyên chở dung dịch nào sau đây?
Phát biểu nào sau đây sai?
Công thức của triolein là
Những tính chất vật lý chung của kim loại (dẫn điện, dẫn nhiệt, dẻo, ánh kim) gây nên chủ yếu bởi:
Công thức chung của anđehit no, đơn chức, mạch hở là
Etylamin (C2H5NH2) tác dụng được với chất nào sau đây trong dung dịch?
Crom (VI) oxit (CrO3) có màu
Kim loại nào sau đây tan hết trong nước dư ở nhiệt độ thường?
Dung dịch chất nào sau đây hòa tan Cu(OH)2, thu được dung dịch có màu xanh lam?
Dẫn V lít khí CO qua ống sứ đựng lượng dư bột CuO nung nóng. Sau khi hản ứng hoàn toàn thấy khối lượng chất rắn giản 2,0 gam so với ban đầu. Giá trị của V là
Phát biểu nào sau đây đúng?
Phát biểu nào sau đây đúng?
Khi đốt cháy hoàn toàn 4,32 gam hỗn hợp glucozơ và saccarozơ cần vừa đủ 0,15 mol O2, thu được CO2 và m gam H2O. Giá trị của m là
Cho 2,0 gam hỗn hợp X gồm metylamin, đimetylamin phản ứng vừa đủ với 0,05 mol HCl, thu được m gam muối. Giá trị của m là
Khi nói về saccarozơ, khẳng định nào sau đây không đúng?
Hòa tan hoàn toàn 13,8 gam hỗn hợp X gồm Al, Fe vào dung dịch H2SO4 loãng, thu được 10,08 lít khí. Phần trăm khối lượng của Al trong X là:
Đun nóng este HCOOCH3 với một lượng vừa đủ dung dịch NaOH sản phẩm thu được là
Cho Fe lần lượt tác dụng với các dung dịch: H2SO4 loãng, CuSO4, HCl, HNO3 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, số trường hợp sinh ra muối sắt (II) là:
A. 1
B. 2
C. 3
D. 4
Thực hiện phản ứng este hóa giữa 4,6 gam ancol etylic với lượng dư axit axetic, thu được 4,4 gam este. Hiệu suất phản ứng este hóa là
Cho các phát biểu sau:
(a) Tinh bột và xenlulozơ là hai đồng phân cấu tạo của nhau.
(b) Hai đồng phân amino axit của C3H7NO2, tạo ra tối đa 3 đipeptit.
(c) Khi đun nóng glucozơ hoặc saccarozơ với dung dịch AgNO3 trong NH3 thu được Ag.
(d) Thành phần chính của tơ tằm là xenlulozơ.
(e) Nồng độ glucozơ trong máu người bình thường khoảng 1%.
(f) Tất cả protein đều là chất rắn, không tan trong nước.
(g) Tất cả chất béo khi thủy phân đều có tạo ra glixerol.
Số phát biểu đúng là
A. 1
B. 3
C. 4
D. 2
Cho các phát biểu sau:
(a) Phân lân cung cấp cho cây trồng nguyên tố photpho.
(b) Điện phân (điện cực trơ) dung dịch CuSO4 có thể thu được 3 đơn chất.
(c) Cho phân đạm ure vào dung dịch nước vôi trong dư, thu được kết tủa trắng và khí không màu.
(d) Cho Al2O3 vào dung dịch HNO3 loãng, thu được khí không màu hóa nâu trong không khí.
(e) Nối các lá kẽm với vỏ tàu bằng thép thì vỏ tàu được bảo vệ bằng phương pháp điện hóa.
Số phát biểu đúng là
A. 5
B. 3
C. 4
D. 2
Giả thiết 20% lượng etanol 96o thu được từ 5,00 tấn sắn khô này được dùng để pha chế dung dịch sát khuẩn. Biết rằng để pha chế 10,00 lít dung dịch sát khuẩn sử dụng trong phòng dịch Covid-19, Tổ chức Y tế Thế giới WHO giới thiệu một công thức sau:
|
Dung dịch etanol (rượu etylic) 96o |
8333,00 ml |
|
Dung dịch hiđro peoxit 3% |
417,00 ml |
|
Dung dịch glixerol 98% |
145,00 ml |
|
Nước cất đã đun sôi, để nguội |
Phần còn lại |
Thể tích dung dịch sát khuẩn được tạo ra là:
Thủy phân hoàn toàn m gam hỗn hợp X gồm các triglixerit trong dung dịch NaOH, thu được glixerol và hỗn hợp Y gồm ba muối C15H31COONa, C17HxCOONa và C17HyCOONa có tỉ lệ mol tương ứng là 1 : 2 : 1. Đốt cháy hoàn toàn m gam X cần vừa đủ 6,31 mol O2, thu được H2O và 4,44 mol CO2. Mặt khác, cho 41,64 gam X trên tác dụng tối đa với a mol Br2 trong dung dịch. Giá trị của a là:
Một mẫu cồn X (thành phần chính là etanol) có lẫn metanol. Khi được đốt cháy hoàn toàn, 1 mol etanol tỏa ra lượng nhiệt là 1370 kJ và 1 mol metanol tỏa ra lượng nhiệt là 716 kJ. Đết cháy hoàn toàn 10 gam mẫu cồn X tỏa ra một nhiệt lượng là 291,9 kJ. Phần trăm tạp chất metanol trong mẫu cồn X là
Hòa tan hoàn toàn hỗn hợp X gồm Mg, MgO, Fe3O4 và Fe(NO3)2 (trong đó oxi chiếm 371/1340 khối lượng hỗn hợp X) trong dung dịch HCl dư thấy có 4,61 mol HCl phản ứng. Sau khi các phản ứng xảy ra xong thu được dung dịch Y chỉ chứa 238,775 gam muối clorua và 14,56 lít (đktc) hỗn hợp khí Z gồm NO, H2. Hỗn hợp Z có tỉ khối so với H2 là 69/13. Thêm dung dịch NaOH dư vào Y, sau phản ứng thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi được 114,2 gam chất rắn T. Phần trăm khối lượng Fe3O4 trong X gần nhất với giá trị nào sau đây?
Hỗn hợp E gồm axit cacboxylic X (không no, hai chức, mạch hở, có 3 liên kết p trong phân tử, có đồng phân hình học), hai ancol Y, Z (no, đơn chức, mạch hở, kế tiếp nhau, MY < MZ) và este T hai chức được tạo bởi X và hai ancol Y, Z. Đốt cháy a gam hỗn hợp E, thu được 15,84 gam CO2 và 4,50 gam H2O. Mặt khác, khi đun nóng a gam E với 160,00 ml dung dịch NaOH 1,00 M thì để trung hòa NaOH dư cần 10,00 ml dung dịch H2SO4 1,00 M, thu được dung dịch F. Cô cạn F, thu được m gam muối khan và 2,02 gam hỗn hợp G gồm hai ancol. Cho G tác dụng với Na dư, thu được 0,56 lít khí H2 (đktc). Biết các phản ứng xảy ra hoàn toàn. Giá trị m là bao nhiêu:
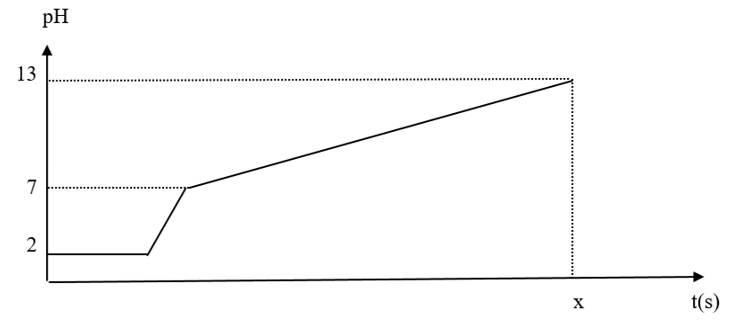
Điện phân 400 ml dung dịch gồm NaCl, HCl và CuSO4 0,02M với điện cực trơ và màn ngăn xốp. Cường độ đòng điện là 1,93 A. Coi thể tích dung dịch không thay đổi trong quá trình điện phân. Chỉ số pH theo thời gian được biểu diễn bằng đồ thị sau đây (xét ở nhiệt độ 250C, hiệu suất điện phân 100%)
Cho sơ đồ phản ứng sau:
2X1 + 2H2O → 2X2 + X3 + H2
2X2 + X4 → BaCO3 + Na2CO3 + 2H2O
X4 + 2X5 → BaSO4 + K2SO4 + 2CO2 + 2H2O
Các chất X1, X4, X5 lần lượt là:
Hợp chất A có công thức phân tử là C12H12O4. Thực hiện sơ đồ chuyển hóa sau:
(a) A + 3KOH → B + C + D + H2O (b) B + 2HCl → A1 + 2KCl
(c) CH3CH=O + H2 → D (d) C + HCl → C1 + NaCl
(e) C1 + Br2 → CH2BrCHBrCOOH
Biết A1 chứa vòng benzen. Khối lượng mol phân tử của A1 là