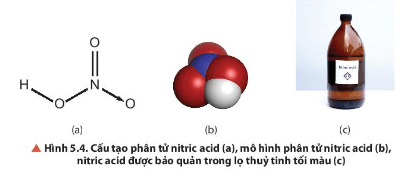
Quan sát Hình 5.4a, cho biết các liên kết hoá học giữa các nguyên tử trong phân tử HNO3 thuộc loại liên kết gì. Xác định số oxi hoá của nitrogen trong HNO3. Dự đoán vai trò của HNO3 trong các phản ứng oxi hoá – khử.
Giải Hóa Học 11 (Chân trời sáng tạo) Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 5 trang 29 Hóa học 11: Viết phương trình hoá học của các phản ứng xảy ra khi cho dung dịch (NH4)2SO4 tác dụng với dung dịch NaOH, dung dịch Ba(OH)2, dung dịch BaCl2, dung dịch Ba(NO3)2.
Lời giải:
Các phương trình hoá học xảy ra:
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3↑ + 2H2O.
(NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O.
(NH4)2SO4 + BaCl2 → BaSO4↓ + 2NH4Cl.
(NH4)2SO4 + Ba(NO3)2 → BaSO4↓ + 2NH4NO3.
Bài làm:
Giải Hóa Học 11 (Chân trời sáng tạo) Bài 4: Ammonia và một số hợp chất ammonium
Bài 4 trang 29 Hóa học 11: Cho cân bằng hoá học:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Cân bằng chuyển dịch theo chiều nào (có giải thích) khi:
a) tăng nhiệt độ.
b) tách ammonia ra khỏi hỗn hợp phản ứng.
c) giảm thể tích của hệ phản ứng.
Giải Hóa Học 11 (Chân trời sáng tạo) Bài 4: Ammonia và một số hợp chất ammonium
Bài 3 trang 29 Hóa học 11: Khi thải rác thải sinh hoạt chứa một lượng lớn ion ammonium vào ao, hồ sẽ xảy ra quá trình oxi hoá ammonium thành ion nitrate dưới tác dụng của vi khuẩn. Quá trình này làm giảm oxygen hoà tan trong nước, gây ngạt cho sinh vật sống dưới nước. Người ta phải xử lí nguồn nước gây ô nhiễm đó bằng cách chuyển ion ammonium thành ammonia rồi chuyển tiếp thành nitrogen không độc. Hãy đề xuất một số hoá chất để thực hiện quá trình trên và viết phương trình hoá học của các phản ứng xảy ra.
Giải Hóa Học 11 (Chân trời sáng tạo) Bài 4: Ammonia và một số hợp chất ammonium
Câu hỏi thảo luận 7 trang 26 Hóa học 11: Dựa vào nguyên lí chuyển dịch cân bằng Le Chatelier, hãy cho biết để tăng hiệu suất tổng hợp NH3, cần điều chỉnh nhiệt độ và áp suất như thế nào. Điều đó có gây trở ngại gì cho phản ứng tổng hợp NH3 trên thực tế hay không? Vì sao?
Giải Hóa Học 11 (Chân trời sáng tạo) Bài 4: Ammonia và một số hợp chất ammonium
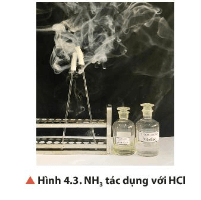
Câu hỏi thảo luận 5 trang 25 Hóa học 11: Chuẩn bị hai đầu đũa thuỷ tinh quấn bông. Đũa 1 nhúng vào dung dịch HCl đặc, đũa 2 nhúng vào dung dịch NH3 đặc, sau đó đưa lại gần nhau (Hình 4.3). Quan sát và nêu hiện tượng xảy ra. Từ đó, đề xuất phương pháp nhận biết ammonia bằng dung dịch HCl đặc.
Giải Hóa Học 11 (Chân trời sáng tạo) Bài 4: Ammonia và một số hợp chất ammonium