245 Bài tập tổng hợp Hóa vô cơ cực hay có lời giải (P1)
- 1Làm xong biết đáp án, phương pháp giải chi tiết.
- 2Học sinh có thể hỏi và trao đổi lại nếu không hiểu.
- 3Xem lại lý thuyết, lưu bài tập và note lại các chú ý
- 4Biết điểm yếu và có hướng giải pháp cải thiện
Trong các ion sau đây, ion nào có tính oxi hóa mạnh nhất?
A. Cu2+
B. Zn2+.
C. Ag+.
D. Ca2+.
Trong tự nhiên, canxi sunfat tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là
A. thạch cao nung
B. đá vôi.
C. boxit
D. thạch cao sống
Để phân tích định tính các nguyên tố trong hợp chất hữu cơ, người ta thực hiện một thí nghiệm được mô tả như hình vẽ:

Phát biểu nào sau đây đúng?
A. Thí nghiệm trên dùng để xác định clo có trong hợp chất hữu cơ
B. Thí nghiệm trên dùng để xác định nitơ có trong hợp chất hữu cơ.
C. Trong thí nghiệm trên có thể thay dung dịch Ca(OH)2 bằng dung dịch Ba(OH)2
D. Bông trộn CuSO4 khan có tác dụng chính là ngăn hơi hợp chất hữu cơ thoát ra khỏi ống nghiệm
Phát biểu nào sau đây sai?
A. Trong tự nhiên, các kim loại kiềm chỉ tồn tại ở dạng đơn chất
B. Sắt có trong hemoglobin (huyết cầu tố) của máu
C. Phèn chua được dùng để làm trong nước đục.
D. Hợp kim liti – nhôm siêu nhẹ, được dùng trong kĩ thuật hàng không
Cho các nhóm tác nhân hoá học sau:
(1) Ion kim loại nặng như Hg2+, Pb2+.
(2) Các anion NO3-, SO42-, PO43- ở nồng độ cao.
(3) Thuốc bảo vệ thực vật.
(4) CFC (khí thoát ra từ một số thiết bị làm lạnh)
Những nhóm tác nhân đều gây ô nhiễm nguồn nước là:
A. (1), (3), (4).
B. (2), (3), (4).
C. (1), (2), (4).
D. (1), (2), (3).
Tiến hành thí nghiệm với các dung dich muối clorua riêng biệt của các cation: X2+, Y3+, Z3+, T2+. Kết quả được ghi ở bảng sau:
|
Mẫu thử chứa |
Thí nghiệm |
Hiện tượng |
|
X2+ |
Tác dụng với Na2SO4 trong H2SO4 loãng |
Có kết tủa trắng |
|
Y3+ |
Tác dụng với dung dịch NaOH. |
Có kết tủa nâu đỏ |
|
Z3+ |
Nhỏ từ từ dung dịch NaOH loãng vào đến dư |
Có kết tủa keo trắng, sau đó kết tủa tan |
|
T2+ |
Nhỏ từ từ dung dịch NH3 vào đến dư. |
Có kết tủa xanh, sau đó kết tủa tan tạo dung dịch màu xanh lam. |
Các cation X2+, Y3+, Z3+, T2+ lần lượt là
A. Ba2+, Fe3+, Al3+, Cu2+
B. Ca2+, Au3+, Al3+, Zn2+.
C. Ba2+, Cr2+, Fe3+, Mg2+
D. Mg2+, Fe3+, Cr3+, Cu2+
Thực hiện các thí nghiệm sau ở nhiệt độ thường:
(a) Cho bột Al vào dung dịch NaOH.
(b) Cho bột Fe vào dung dịch AgNO3.
(c) Cho CaO vào nước.
(d) Cho dung dịch Na2CO3 vào dung dịch CaCl2.
Số thí nghiệm có xảy ra phản ứng là
A. 3
B. 1
C. 2
D. 4
Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư;
(b) Sục khí Cl2 vào dung dịch FeCl2;
(c) Dẫn khí H2 dư qua bột CuO nung nóng;
(d) Cho Na vào dung dịch CuSO4 dư;
(e) Nhiệt phân AgNO3;
(g) Đốt FeS2 trong không khí;
(h) Điện phân dung dịch CuSO4 với điện cực trơ;
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là:
A. 2
B. 5
C. 4
D. 3
Tiến hành các thí nghiệm sau:
(a) Cho Ca(HCO3)2 vào dung dịch Ca(OH)2.
(b) Cho Zn vào dung dịch FeCl3 (dư).
(c) Cho dung dịch Ba(OH)2 (dư) vào dung dịch Al2(SO4)3.
(d) Cho khí CO2 (dư) vào dung dịch hỗn hợp gồm Ba(OH)2 và NaOH.
(e) Cho dung dịch HCl (dư) vào dung dịch NaAlO2.
(f) Cho dung dịch NaOH vào dung dịch MgCl2.
Số thí nghiệm có tạo ra kết tủa là:
A. 1
B. 4
C. 3
D. 2
Phát biểu nào sau đây sai?
A. CuSO4 là chất được dùng để nhận ra sự có mặt của hơi H2O trong phân tích hữu cơ
B. Hàm lượng sắt trong gang cao hơn trong thép thường
C. Quặng boxit có thành phần chính là Al2O3
D. Gương làm từ crôm không bị mờ trong không khí
Cho mẫu nước cứng chứa các ion: Ca2+, Mg2+ và . Hoá chất không thể dùng để làm mềm mẫu nước cứng trên là
A. K3PO4
B. Na2CO3
C. Ca(OH)2
D. HCl
Dãy gồm các ion (không kể sự điện li của H2O) cùng tồn tại trong một dung dịch là
A. Cu2+, NO3–, H+, Cl–.
B. Fe2+, K+, OH–, Cl–.
C. Ba2+, HSO4–, K+, NO3–.
D. Al3+, Na+, S2–, NO3–.
Cho dãy chuyển hóa sau: X Y + Z ; Y Z + CO2 + H2O
Công thức của X là
A. NaHCO3
B. (NH4)2CO3
C. Na2CO3
D. NH4HCO3
Tác nhân chủ yếu gây mưa axit là
A. CH4 và NH3
B. CO và CH4
C. SO2 và NO2
D. CO và CO2
Cho dãy biến đổi sau: Cr X Y Z T
X, Y, Z, T là
A. CrCl2, CrCl3, NaCrO2, Na2CrO4
B. CrCl2, CrCl3, NaCrO2, Na2Cr2O7
C. CrCl2, CrCl3, NaCrO2, Na2CrO7
D. CrCl2, CrCl3, Cr(OH)3, Na2CrO4
Kết luận nào sau đây không đúng ?
A. Thuốc thử đặc trưng dể nhận biết ion NO3– trong dung dịch muối nitrat là Cu
B. Thuốc thử đặc trưng để nhận biết ion Cl– là dung dịch AgNO3/HNO3.
C. Thuốc thử đặc trưng dể nhận biết anion SO42– là dung dịch BaCl2/HNO3
D. Thuốc thử có thể dùng để nhận biết HCO3–, CO32– là axit mạnh
Thí nghiệm nào sau đây có kết tủa sau phản ứng?
A. Cho dung dịch NH3 đến dư vào dung dịch AlCl3
B. Cho dung dịch NaOH đến dư vào dung dịch Cr(NO3)3
C. Thổi CO2 đến dư vào dung dịch Ca(OH)2
D. Cho dung dịch HCl đến dư vào dung dịch NaAlO2
Hấp thụ hoàn toàn 4,48 lít CO2 (đktc) vào 200 ml dung dịch chứa Na2CO3 0,5M và NaOH 0,75M thu được dung dịch X. Cho BaCl2 dư vào X, khối lượng kết tủa thu được là
A. 15,76 gam
B. 19,70 gam
C. 9,85 gam
D. 7,88 gam
Cho sơ đồ phản ứng sau:
Các chất X2, X5, X6 theo thứ tự là
A. NaOH, NaClO, KHSO4
B. KOH, KClO3, H2SO4
C. NaHCO3, NaClO, KHSO4
D. NaOH, NaClO, H2SO4
Tiến hành các thí nghiệm sau:
(a) Điện phân NaCl nóng chảy
(b) Điện phân dung dịch CuSO4 (điện cực trơ, màng ngăn xốp)
(c) Cho mẩu K vào dung dịch AlCl3
(d) Cho Fe vào dung dịch AgNO3
(e) Cho Ag vào dung dịch HCl
(g) Cho Cu vào dung dịch hỗn hợp Mg(NO3)2 và NaHSO4
(h) Nung hỗn hợp Al và Fe3O4 trong bình kín
(i) Nung nóng hỗn hợp Fe và S trong bình kín
Số thí nghiệm thu được chất khí là:
A. 4
B. 7
C. 6
D. 5
Trong các mệnh đề sau, mệnh đề nào không đúng ?
A. SO2 và NOx gây mưa axit.
B. CO2 và CH4 gây hiệu ứng nhà kính.
C. Các ion kim loại nặng, các anion , thuốc bảo vệ thực vật và phân bón hóa học là tác nhân gây ô nhiễm môi trường nước.
D. Các chất ma túy thường gặp là: heroin, moocphin, cocain, amphetamin, nicotin.
Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ chất rắn X như sau:
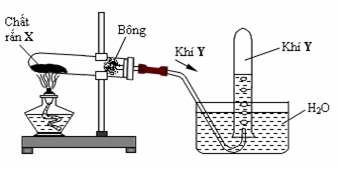
Hình vẽ trên minh họa cho phản ứng nào sau đây?
A. NH4Cl NH3 ↑ + HCl ↑
B. CaC2 + 2H2O → Ca(OH)2 + C2H2
C. BaSO3 BaO + SO2 ↑
D. 2KMnO4 K2MnO4 + MnO2 + O2 ↑
Cho các nhận định sau:
(1) Nhôm là kim loại nhẹ, có tính khử mạnh, dẫn điện, dẫn nhiệt tốt.
(2) Các kim loại kiềm thổ tác dụng được với nước ở điều kiện thường.
(3) Trong công nghiệp, các kim loại kiềm được điều chế bằng phương pháp điện phân dung dịch.
(4) Thành phần cacbon trong gang trắng nhiều hơn trong gang xám.
(5) Trong công nghiệp, crom được dùng để sản xuất và bảo vệ thép.
(6) Phèn chua được dùng trong ngành thuộc da, chất cầm màu trong công nghiệp nhuộm vải.
(7) Các kim loại kiềm dễ cháy trong oxi khi đốt, chỉ tạo thành các oxit.
(8) Ở nhiệt độ cao, các kim loại đứng trước H đều khử được H2O.
Số nhận định đúng là:
A. 3
B. 5
C. 4
D. 6
Tiến hành các thí nghiệm sau:
(a) Nhúng thanh Fe vào dung dịch CuSO4.
(b) Dẫn khí CO qua Fe2O3 nung nóng.
(c) Điện phân dung dịch NaCl bão hòa, có màng ngăn.
(d) Đốt bột Fe trong khí oxi.
(e) Cho kim loại Ag vào dung dịch HNO3 loãng.
(f) Nung nóng Cu(NO3)2.
(g) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng.
Số thí nghiệm có xảy ra sự oxi hóa kim loại là
A. 2
B. 3
C. 4
D. 5
Cho sơ đồ phản ứng:
X dung dịch Y Z.
Cho các chất sau: Al2O3, Cr2O3, CrO3, Cr(OH)2, Cr(OH)3, AlCl3, CrCl2, CrCl3, Na2Cr2O7. Số chất thỏa mãn X ở sơ đồ trên là
A. 2
B. 6
C. 8
D. 4
Hỗn hợp X gồm Na, K, Na2O và K2O. Hòa tan hoàn toàn 25,7 gam X vào nước, thu được 3,36 lít khí H2 (đktc) và dung dịch Y, trong đó có 22,4 gam KOH. Hòa tan hết 0,4 mol H3PO4 vào Y, thu được dung dịch chứa m gam muối. Giá trị của m là
A. 61,0
B. 77,2
C. 49,0
D. 64,0
Có 4 lọ dung dịch riêng biệt X, Y, Z và T chứa các chất khác nhau trong số bốn chất: (NH4)2CO3, KHCO3, NaNO3, NH4NO3. Bằng cách dùng dung dịch Ca(OH)2 cho lần lượt vào từng dung dịch, thu được kết quả sau
|
Chất Thuốc thử |
X |
Y |
Z |
T |
|
Dung dịch Ca(OH)2 |
Kết tủa trắng |
Khí mùi khai |
Không có hiện tượng |
Kết tủa trắng, có khí mùi khai |
Nhận xét nào sau đây đúng?
A. T là dung dịch (NH4)2CO3
B. Y là dung dịch KHCO3
C. Z là dung dịch NH4NO3.
D. X là dung dịch NaNO3.
Tiến hành các thí nghiệm sau:
(a) Sục NH3 dư vào dung dịch AgNO3.
(b) Cho dung dịch Fe(NO3)3 vào dung dịch AgNO3.
(c) Cho hỗn hợp Ba và Al2O3 theo tỉ lệ mol 1:1 vào nước dư.
(d) Cho dung dịch NaAlO2 dư vào dung dịch HCl.
(e) Cho bột Cu và FeCl3 theo tỉ lệ mol 1 : 1 vào nước dư.
(f) Cho FeBr2 vào dung dịch K2Cr2O7 trong H2SO4 dư.
(g) Sục khí NH3 dư vào dung dịch NaCrO2.
(h) Cho hỗn hợp Fe(NO3)2 và Cu (tỉ lệ mol 1:3) vào dung dịch HCl loãng dư.
(i) Cho dung dịch Na2S dư vào dung dịch CaCl2.
(j) Cho 1 mol Al, 1 mol Zn vào dung dịch chứa 3 mol NaOH.
Sau khi kết thúc các phản ứng, số thí nghiệm sau khi kết thúc còn lại chất rắn không tan là
A. 3
B. 4
C. 2
D. 1
Điện phân dung dịch chứa m gam hỗn hợp gồm CuSO4 và KCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi, sau thời gian t giây, ở anot thoát ra 2,688 lít hỗn hợp khí (đktc). Nếu thời gian điện phân là 2t giây; thể tích khí thoát ra ở anot gấp 3 lần thể tích khí thoát ra ở catot (đo cùng điều kiện); đồng thời khối lượng catot tăng 18,56 gam. Giá trị của m là
A. 50,87 gam.
B. 53,42 gam.
C. 55,34 gam.
D. 53,85 gam.
Cho m gam hỗn hợp gồm Na2O và Al2O3 vào 400 ml dung dịch H2SO4 0,3M và HCl 0,9M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào X, phản ứng được biểu diễn theo đồ thị sau:
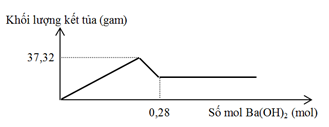
Giá trị của m là
A. 9,84 gam.
B. 17,20 gam.
C. 16,04 gam.
D. 11,08 gam.
Trong số các nguồn năng lượng: (1) thuỷ điện, (2) gió, (3) mặt trời, (4) hoá thạch, những nguồn năng lượng sạch là
A. (1), (3), (4).
B. (2), (3), (4).
C. (1), (2), (4).
D. (1), (2), (3).
Phát biểu sai là:
A. Phương pháp trao đổi ion làm giảm tính cứng của nước cứng tạm thời và nước cứng vĩnh cửu
B. Thạch cao sống có công thức là CaSO4.H2O
C. Hàm lượng cacbon có trong gang cao hơn trong thép
D. Phèn chua có công thức KAl(SO4)2.12H2O được dùng làm trong nước đục
Phản ứng nào sau đây xảy ra ở điều kiện thường ?
A. 3C + 4CrO3 → 2Cr2O3 + 3CO2
B. C + H2O → CO + H2
C. C + CO2 → 2CO
D. C + 2H2 → CH4
Một học sinh làm thí nghiệm điều chế NH3 bằng cách đun nóng NH4Cl với Ca(OH)2, khí NH3 sinh ra thường có lẫn hơi nước. Vậy để làm khô khí NH3 cần dùng hóa chất nào sau đây?
A. NaCl (rắn)
B. dung dịch H2SO4 đặc
C. CuSO4 (rắn)
D. CaO (rắn)
Một mẫu K và Ba tác dụng với H2O dư thu được dung dịch X và 3,36 lít H2. Tính thể tích dung dịch H2SO4 2M cần dùng để trung hoà dung dịch X
A. 150 ml
B. 200 ml
C. 300 ml
D. 75 ml
Muốn tăng cường sức chống bệnh, chống rét và chịu hạn cho cây người ta dùng loại phân bón nào
A. Supephotphat
B. KCl
C. NH4Cl
D. Amophot
Phương trình hóa học sai là
A. 2Cr + 6HCl → 2CrCl3 + 3H2
B. Cu + 2FeCl3 → CuCl2 + 2FeCl2
C. Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
D. 3Mg (dư) + 2FeCl3 → 3MgCl2 + 2Fe
Tiến hành các thí nghiệm sau: (a) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(b) Dẫn khí H2 (dư) qua bột MgO nung nóng.
(c) Cho dung dịch AgNO3 tác dụng với dung dịch Fe(NO3)2 dư.
(d) Cho Na vào dung dịch MgSO4.
(e) Đốt FeS2 trong không khí.
(f). Điện phân dung dịch Cu(NO3)2 với các điện cực trơ
Số thí nghiệm không tạo thành kim loại là
A. 4
B. 2
C. 3
D. 5
Dung dịch X chứa các ion: Ca2+, Na+, HCO3- và Cl–, trong đó số mol của ion Cl– là 0,07. Cho 1/2 dung dịch X phản ứng với dung dịch NaOH (dư), thu được 2 gam kết tủa. Cho 1/2 dung dịch X còn lại phản ứng với dung dịch Ca(OH)2 (dư), thu được 4,5 gam kết tủa. Mặt khác, nếu đun sôi đến cạn dung dịch X rồi nung đến khối lượng không đổi thì thu được m gam chất rắn. Giá trị của m là
A. 6,865.
B. 6,645
C. 8,79.
D. 8,625.
Cho các thí nghiệm sau (a) Cho dung dịch Ca(OH)2 dư vào dung dịch Ca(HCO3)2.
(b) Cho dung dịch Ba(OH)2 dư vào dung dịch Al2(SO4)3.
(c) Cho dung dịch HCl dư vào dung dịch NaAlO2.
(d) Dẫn khí CO2 dư vào dung dịch NaAlO2.
(e) Cho dung dịch NaOH dư vào dung dịch AlCl3.
(f) Cho dung dịch NH3 dư vào dung dịch Al2(SO4)3.
(g) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2.
Số thí nghiệm không thu được kết tủa là:
A. 3
B. 2
C. 4
D. 1
Cho các thí nghiệm sau: (a) Cho 1 mol NaHCO3 tác dụng với 1 mol KOH trong dung dịch.
(b) Cho 1 mol Fe tác dụng 2,5 mol AgNO3 trong dung dịch.
(c) Cho 1 mol C6H5OOC-CH3 (phenyl axetat) tác dụng với 3 mol NaOH, đun nóng trong dung dịch.
(d) Cho 1 mol ClH3NCH2COOH tác dụng với 2 mol NaOH trong dung dịch.
(e) Cho 1 mol Fe3O4 và 2 mol Cu tác dụng với dung dịch HCl dư.
(f) Cho 2 mol CO2 tác dụng với 3 mol NaOH trong dung dịch.
(g) Cho 14 mol HCl vào dung dịch chứa 1 mol K2Cr2O7.
Số thí nghiệm sau khi kết thúc thu được dung dịch chỉ chứa 2 chất tan là
A. 4
B. 6
C. 5
D. 3
Phản ứng nào sau đây là phản ứng trao đổi ion?
A. Na2HPO4 + NaOH → Na3PO4 + H2O
B. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
C. Fe(NO3)2 + AgNO3 Fe(NO3)3 + Ag
D. CaCO3 CaO + CO2
Cho hỗn hợp gồm Na, K, Ba vào 200 ml dung dịch CuCl2 0,6M. Sau khi kết thúc các phản ứng, thu được 2,24 lít khí H2 (đktc) và m gam kết tủa. Giá trị m là
A. 4,90 gam.
B. 19,60 gam.
C. 9,80 gam.
D. 11,76 gam.
Phương án nào sau đây không đúng?
A. Cs được dùng làm tế bào quang điện.
B. Thạch cao sống được dùng để nặn tượng, đúc khuôn và bột bó khi gãy xương...
C. Na2CO3 là hóa chất quan trọng trong công nghiệp thủy tinh, bột giặt ...
D. Ca(OH)2 được dùng rộng rãi trong nhiều ngành công nghiệp: sản xuất amoniac, clorua vôi, vật liệu xây dựng...
Hòa tan hết m gam hỗn hợp Na, Na2O và ZnO vào 300 ml dung dịch NaOH 0,5M thu được dung dịch X và 1,792 lít khí H2 (đktc). Cho từ từ dung dịch HCl 1M vào X, đến khi bắt đầu xuất hiện kết tủa thì đã dùng 80 ml. Nếu cho 320 ml hoặc 480 ml dung dịch HCl 1M vào X, đều thu được a gam kết tủa. Giá trị của m là
A. 24,08 gam.
B. 23,60 gam.
C. 22,22 gam.
D. 19,43 gam.
Cho các phát biểu sau:
(a) Nhôm và crom đều phản ứng với clo theo cùng tỉ lệ mol.
(b) Ở nhiệt độ thường, tất cả các kim loại kiềm thổ đều tác dụng được với nước.
(c) Nhôm bền trong môi trường không khí và nước là do có màng oxit Al2O3bền vững bảo vệ.
(d) Theo chiều tăng dần của điện tích hạt nhân, nhiệt độ nóng chảy của kim loại kiềm thổ giảm dần.
(e) Trong công nghiệp, gang chủ yếu được sản xuất từ quặng manhetit.
(f) Hợp chất crom (VI) như CrO3, K2Cr2O7 có tính khử rất mạnh.
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4