245 Bài tập tổng hợp Hóa vô cơ cực hay có lời giải (P2)
- 1Làm xong biết đáp án, phương pháp giải chi tiết.
- 2Học sinh có thể hỏi và trao đổi lại nếu không hiểu.
- 3Xem lại lý thuyết, lưu bài tập và note lại các chú ý
- 4Biết điểm yếu và có hướng giải pháp cải thiện
Thực hiện các thí nghiệm sau:
(1) Điện phân dung dịch NaCl bằng điện cực trơ, không có màng ngăn xốp.
(2) Cho BaO vào dung dịch CuSO4.
(3) Cho dung dịch FeCl3 vào dung dịch AgNO3.
(4) Nung nóng hỗn hợp bột gồm ZnO và cacbon trong điều kiện không có không khí ở nhiệt độ cao.
(5) Đốt cháy HgS trong khí oxi dư.
(6) Dẫn luồng khí NH3 qua ống sứ chứa CrO3.
(7) Nung nóng hỗn hợp bột gồm Al và CrO trong khí trơ.
(8) Cho khí CO tác dụng với Fe3O4 nung nóng.
(9) Nung hỗn hợp Mg, Mg(OH)2 trong khí trơ.
(10) Nung hỗn hợp Fe, Fe(NO3)2 trong khí trơ.
Số thí nghiệm luôn thu được đơn chất là
A. 8
B. 7
C. 5
D. 6
Điện phân (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) V lít dung dịch X chứa đồng thời R(NO3)2 0,45M (R là kim loại hóa trị không đổi) và NaCl 0,4M trong thời gian t giây, thu được 6,72 lít hỗn hợp khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 400 ml dung dịch chứa KOH 0,75M và NaOH 0,5M, không sinh ra kết tủa. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của V là
A. 0,75
B. 2,00
C. 0,50
D. 1,00
Phương trình hóa học nào sau đây là sai ?
A. Fe + CuSO4 → FeSO4 + Cu
B. Cu + H2SO4 → CuSO4 + H2
C. 2Na + 2H2O → 2NaOH + H2
D. Ca + 2HCl → CaCl2 + H2.
Khí sinh ra trong trường hợp nào sau đây không gây ô nhiễm không khí?
A. Quá trình đốt nhiên liệu trong động cơ ô tô.
B. Quá trình đốt nhiên liệu trong lò cao
C. Quá trình quang hợp của cây xanh.
D. Quá trình đun nấu, đốt lò sưởi trong sinh hoạt.
Hiện tượng xảy ra khi nhỏ vài giọt dung dịch H2SO4 vào dung dịch Na2CrO4 là:
A. Dung dịch chuyển từ màu da cam sang màu vàng
B. Dung dịch chuyển từ màu vàng sang màu da cam
C. Dung dịch chuyển từ màu vàng sang không màu
D. Dung dịch chuyển từ không màu sang màu da cam
Từ hai :muối X và Y thực hiện các phản ứng sau
X → X1 + CO2
X1 + H2O → X2
X2 + Y → X + Y1 + H2O
X2 + 2Y → X + Y2 + 2H2O
Hai muối X, Y tương ứng là ?
A. MgCO3, NaHCO3
B. CaCO3, NaHCO3
C. CaCO3, NaHSO4
D. BaCO3, Na2CO3
Thứ tự từ trái sang phải của một số cặp oxi hóa - khử trong dãy điện hóa như sau: Mg2+/Mg; Al3+/Al; Cr2+/Cr; Zn2+/Zn; Fe2+/Fe; Cu2+/Cu. Dãy chỉ gồm các kim loại tác dụng được với Zn2+ trong dung dịch là
A. Mg, Al, Zn
B. Al, Fe, Cu
C. Mg, Al, Cr
D. Cr, Fe, Cu
Cho các phản ứng sau:
(a) FeS + 2HCl → FeCl2 + H2S
(b) Na2S + 2HCl → 2NaCl + H2S
(c) 2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3 + 3H2S + 6NaCl
(d) KHSO4 + KHS → K2SO4 + H2S
(e) BaS + H2SO4 (loãng) → BaSO4 + H2S
Số phản ứng có phương trình ion rút gọn S2‒ + 2H+ → H2S là
A. 2
B. 1
C. 3
D. 4
Thực hiện sơ đồ chuyển hóa sau (đúng với tỉ lệ mol các chất):
(1) X + NaOH → Y + H2O
(2) Y + 3HCl → Z + 2NaCl.
Biết rằng, trong Z phần trăm khối lượng của clo chiếm 19,346%. Nhận định không đúng là:
A. Đốt cháy 1 mol Y thu được Na2CO3 và 8 mol hỗn hợp gồm CO2, H2O, N2
B. Z tác dụng tối đa với CH3OH/HCl thu được sản phẩm có công thức C7H14O4NCl
C. Z có tính lưỡng tính
D. Dung dịch X làm quỳ tím hóa xanh
Tiến hành các thí nghiệm sau
(1) Cho dung dịch Fe(NO3)2 vào dung dịch H2SO4.
(2) Cho CuS + dung dịch HCl
(3) Cho FeS + dung dịch HCl
(4) Cho dung hỗn hợp Al và Na2O vào nước
(5) Cho dung dịch NaHCO3 vào dung dịch NaOH
(6) Cho dung dịch NH4NO3 vào dung dịch NaOH
(7) Cho Zn vào dung dịch NaHSO4
(8) Cho Cr vào dung dịch NaOH đặc, nóng
Số thí nghiệm có tạo ra chất khí là
A . 4
B. 3
C. 6
D. 5
Trộn dung dịch X (NaOH 0,1M và Ba(OH)2 0,2M) với dung dịch Y (HCl 0,2M và H2SO4 0,1M) theo tỉ lệ nào về thể tích để được dung dịch có pH = 13
A 5:3
B. 4:5
C. 5:4
D. 3:2
Cho các hỗn hợp (tỉ lệ mol tương ứng) sau:
(a) Al và Na (1 : 2) vào nước dư.
(b) Fe2(SO4)3 và Cu (1 : 1) vào nước dư.
(c) Cu và Fe2O3 (2 : 1) vào dung dịch HCl dư.
(d) BaO và Na2SO4 (1 : 1) vào nước dư.
(e) Al4C3 và CaC2 (1 : 2) vào nước dư.
(f) BaCl2 và NaHCO3 (1 : 1) vào dung dịch NaOH dư.
Số hỗn hợp chất rắn tan hoàn toàn và chỉ tạo thành dung dịch trong suốt là:
A. 5
B. 3
C. 4
D. 6
Thực hiện các thí nghiệm sau:
(1) Cho a mol Cu vào dung dịch chứa a mol FeCl3.
(2) Cho dung dịch chứa 2a mol Ba(OH)2 vào dung dịch chứa a mol AlCl3.
(3) Cho Fe3O4 vào dung dịch HNO3 loãng, dư.
(4) Cho hỗn hợp gồm Fe2O3 và CuO vào dung dịch H2SO4 loãng, dư.
(5) Cho CrO3 vào dung dịch NaOH loãng, dư.
(6) Cho a mol Ba vào dung dịch chứa 2a mol NaHSO4.
Số thí nghiệm thu được hai muối là:
A. 3
B. 5
C. 4
D. 6
Hấp thụ hết 4,48 lít CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Lấy 100 ml dung dịch X cho từ từ vào 300 ml dung dịch HCl 0,5M thu được 2,688 lít khí (đktc). Mặt khác, 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư thu được 39,4 gam kết tủa. Giá trị của x là
A. 0,15
B. 0,1
C. 0,06
D. 0,2
Cho một lượng tinh thể Cu(NO3)2.3H2O vào 300 ml dung dịch NaCl 0,6M thu được dung dịch X. Tiến hành điện phân dung dịch X bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi I = 5A, đến khi khối lượng dung dịch giảm 18,65 gam thì dừng điện phân. Nhúng thanh Fe vào dung dịch sau điện phân, kết thúc phản ứng thu được 0,035 mol khí NO (sản phẩm khử duy nhất của N+5; đồng thời khối lượng thanh Fe giảm 2,94 gam. Thời gian điện phân là:
A. 6176 giây
B. 6948 giây
C. 8106 giây
D. 7334 giây
Phát biểu nào sau đây đúng ?
A. Nước cứng là nước chứa nhiều ion HCO3–, SO42–, Cl–.
B. Các kim loại kiềm thổ đều cùng kiểu mạng tinh thể lập phương tâm diện.
C. Hỗn hợp tecmit (dùng để hàn gắn đường ray) gồm bột Fe và Al2O3.
D. Thành phần chính của quặng boxit là Al2O3.2H2O.
Khi tiến hành thí nghiệm sinh ra các khí độc như SO2, H2S, Cl2, NO2. Để hạn chế các khí này thoát ra từ ống nghiệm một cách có hiệu quả nhất đồng thời tiết kiệm nhất, chúng ta thường nút ống nghiệm bằng bông tẩm dung dịch nào ?
A. Dung dịch nước vôi trong, Ca(OH)2.
B. Dung dịch Ba(OH)2.
C. Dung dịch xút ăn da, NaOH.
D. Dung dịch potat ăn da, KOH.
Hợp chất nào sau đây không tan trong dung dịch NaOH loãng dư ?
A. Cr2O3.
B. K2Cr2O7.
C. NaCrO2.
D. CrO3.
Nung m gam đá vôi có chứa 80% CaCO3 được V lít CO2 (đktc). Cho lượng CO2 thu được tác dụng với dung dịch có chứa 80 gam NaOH chỉ cho được một muối hiđrocacbonat X duy nhất. Giá trị của m là
A. 200.
B. 250.
C. 160.
D. 125.
Ba dung dịch X, Y, Z thoả mãn:
- X tác dụng với Y thì có kết tủa xuất hiện;
- Y tác dụng với Z thì có kết tủa xuất hiện;
- X tác dụng với Z thì có khí thoát ra.
X, Y, Z lần lượt là:
A. NaHCO3, NaHSO4, BaCl2.
B. Al2(SO4)3, BaCl2, Na2SO4.
C. FeCl2, Ba(OH)2, AgNO3.
D. NaHSO4, BaCl2, Na2CO3.
Cho các phát biểu sau:
(a) Cr2O3 là oxit lưỡng tính và được dùng tạo màu lục cho đồ sứ, đồ thủy tinh.
(b) Trong các phản ứng, cation Cr3+ vừa thể hiện tính khử, vừa thể hiện tính oxi hóa.
(c) Crom (VI) oxit bốc cháy khi tiếp xúc với lưu huỳnh, cacbon, photpho, amoniac.
(d) Cho vài giọt dung dịch H2SO4 đặc vào dung dịch K2Cr2O7, màu của dung dịch không thay đổi.
(e) Rubi nhân tạo được sản xuất bằng cách nung hỗn hợp Al2O3, TiO2, Fe3O4.
(g) Trong điện phân, anot xảy ra quá trình oxi hóa; còn trong ăn mòn điện hóa, anot xảy ra quá trình khử.
(h) Ăn mòn kim loại trong thực tiễn chủ yếu là ăn mòn điện hóa.
(i) Tính chất vật lí chung của kim loại là tính dẫn điện, dẫn nhiệt, ánh kim và tính cứng.
(k) Trong các kim loại nhẹ thì Cs có nhiệt độ nóng chảy thấp nhất.
Số phát biểu đúng là:
A. 6
B. 7
C. 4
D. 5
Nhỏ từ từ đến hết 100 ml dung dịch chứa K2CO3 2M và KHCO3 3M vào 200 ml dung dịch HCl 2,1M, thu được khí CO2. Dẫn toàn bộ khí CO2 thu được vào 100 ml dung dịch chứa NaOH 2M và Ba(OH)2 0,8M, kết thúc các phản ứng thu được m gam kết tủa. Giá trị của m là
A. 31,52.
B. 15,76.
C. 11,82.
D. 27,58.
Cho 61,25 gam tinh thể MSO4.5H2O vào 300 ml dung dịch NaCl 0,6M thu được dung dịch X. Tiến hành điện phân dung dịch X bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi, trong thời gian t giây, thấy khối lượng catot tăng m gam; đồng thời ở anot thu được 0,15 mol khí. Nếu thời gian điện phân là 2t giây, tổng số mol khí thoát ra 2 cực là 0,425 mol. Giá trị m là
A. 12,80 gam
B. 13,44 gam
C. 12,39 gam
D. 11,80 gam
Trường hợp nào sau đây không xảy ra phản ứng hóa học?
A. Cho Cr(OH)3 vào dung dịch NaOH loãng
B. Cho bột Fe vào dung dịch CrSO4
C. Cho dung dịch NaOH vào dung dịch K2Cr2O7
D. Cho dung dịch H2SO4 vào dung dịch Na2CrO4
Khí thải công nghiệp và của các động cơ ô tô, xe máy… là nguyên nhân chủ yếu gây ra mưa axit. Thành phần hóa học chủ yếu trong các khí thải trực tiếp gây ra mưa axit là:
A. CO, NO
B. CO, NO2
C. CO2, N2
D. SO2, NO2
Mẫu nước cứng chứa các ion: Mg2+, Ca2+, Cl‒, SO42‒ và HCO3‒. Nhận định sai là:
A. Mẫu nước trên làm mất tác dụng của xà phòng
B. Nếu dùng mẫu nước trên để nấu thức ăn sẽ làm thức ăn mau chín nhưng giảm mùi vị.
C. Mẫu nước trên có cả tính cứng tạm thời và tính cứng vĩnh cửu
D. Dùng dung dịch Na2CO3 có thể làm mềm tính cứng của mẫu nước cứng trên
Quan sát sơ đồ thí nghiệm sau:
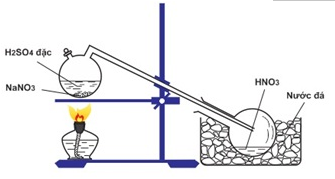
Phát biểu nào sau đây là không đúng về quá trình điều chế HNO3 trong phòng thí nghiệm theo sơ đồ trên ?
A. Bản chất của quá trình điều chế là một phản ứng trao đổi ion
B. Do HNO3 có phân tử khối lớn hơn không khí nên mới thiết kế ống dẫn hướng xuống
C. Quá trình phản ứng là một quá trình thuận nghịch, trong đó chiều thuận là chiều toả nhiệt
D. HNO3 sinh ra trong bình cầu ở dạng hơi nên cần làm lạnh để ngưng tụ
Phản ứng 1 chiều, và hơi HNO3 thoát ra được dẫn vào bình làm lạnh và ngưng tụ.
Tiến hành các thí nghiệm sau:
(a) Cho lá Fe nguyên chất vào dung dịch CuCl2.
(b) Cho lá Ni nguyên chất vào dung dịch HCl.
(c) Cho lá Zn nguyên chất vào dung dịch FeCl3.
(d) Cho lá Ni nguyên chất vào dung dịch FeCl2.
Số thí nghiệm có thể xảy ra ăn mòn điện hóa là
A. 3
B. 4
C. 2
D. 1
Tiến hành các thí nghiệm sau:
(a) Cho Cu dư vào dung dịch Fe(NO3)3.
(b) Sục khí CO2 đến dư vào dung dịch NaOH.
(c) Cho Na2CO3 dư vào dung dịch Ca(HCO3)2.
(d) Cho bột Fe dư vào dung dịch FeCl3.
(e) Cho Fe vào dung dịch HNO3.
(g) Cho Mg vào dung dịch HNO3.
Số thí nghiệm sau phản ứng thu được dung dịch luôn chứa một muối là:
A. 3
B. 5
C. 2
D. 4
Hấp thụ hết a mol khí CO2 vào dung dịch chứa NaOH 1M và Ba(OH)2 0,4M. Sau khi kết thúc các phản ứng, thu được 15,76 gam kết tủa và dung dịch X. Cho từ từ dung dịch HCl 1M vào X đến khi bắt đầu có khí thoát ra thì đã dùng 120 ml. Giá trị của a là
A. 0,12
B. 0,16.
C. 0,18.
D. 0,20
Cho hỗn hợp gồm Mg và Zn có tỉ lệ mol tương ứng 2 : 1 vào 500 ml dung dịch Fe2(SO4)30,2M và CuSO4 0,3M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y và m gam rắn Z. Cho dung dịch NaOH dư vào dung dịch Y, lấy kết tủa nung ngoài không khí đến khối lượng không đổi, thu được 15,2 gam hỗn hợp chứa 2 oxit. Giá trị của m là
A. 12,88 gam
B. 9,60 gam
C. 17,44 gam
D. 13,32 gam
Tiến hành điện phân dung dịch chứa m gam hỗn hợp CuSO4 và KCl bằng dòng điện một chiều có cường độ 2A (điện cực trơ, có màng ngăn xốp). Kết quả thí nghiệm được ghi trong bảng sau:
|
Thời gian điện phân (giây) |
t |
t + 3378 |
2t |
|
Tổng số mol khí ở 2 điện cực |
a |
a + 0,035 |
2,0625a |
|
Số mol Cu ở catot |
b |
b + 0,025 |
b + 0,025 |
Giả sử hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m gần nhất với:
A. 14,70
B. 17,00
C. 18,60.
D. 16,30
Hòa tan hoàn toàn m gam hỗn hợp chất rắn X gồm Ba, BaO, Na, Al2O3 chỉ thu được dung dịch Y và 10,08 lít khí H2 (đktc). Nhỏ từ từ dung dịch H2SO4 vào dung dịch Y thu được kết quả như đồ thị dưới đây: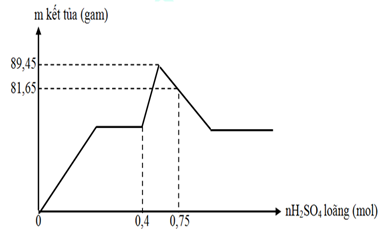
Giá trị m gần nhất với giá trị nào dưới đây ?
A. 78
B. 76
C. 73
D. 75
Hiện tượng xảy ra khi cho dung dịch KOH loãng vào dung dịch K2Cr2O7 là
A. Không có hiện tượng chuyển màu.
B. Dung dịch từ màu vàng chuyển sang màu da cam.
C. Xuất hiện kết tủa trắng.
D. Dung dịch từ màu da cam chuyển sang màu vàng.
Cho a gam hỗn hợp bột gồm Ni và Cu vào dung dịch AgNO3 (dư). Sau khi kết thúc phản ứng thu được 54 gam chất rắn. Mặt khác cũng cho a gam hỗn hợp 2 kim loại trên vào dung dịch CuSO4 (dư), sau khi kết thúc phản ứng thu được chất rắn có khối lượng (a + 0,5) gam. Giá trị của a là
A. 33,7 gam.
B. 53,5 gam.
C. 15,5 gam.
D. 42,5 gam.
Hòa tan 17 gam hỗn hợp X gồm K và Na vào nước được dung dịch Y và 6,72 lít H2 (đktc). Để trung hòa một nửa dung dịch Y cần dùng dung dịch hỗn hợp H2SO4 và HCl (tỉ lệ mol 1 : 2). Tổng khối lượng muối được tạo ra trong dung dịch sau phản ứng là
A. 21,025 gam.
B. 20,65 gam
C. 42,05 gam.
D. 14,97 gam.
Có các thí nghiệm sau:
(a) Nhỏ dung dịch HCl đặc vào tinh thể K2Cr2O7.
(b) Cho Ba vào dung dịch CuSO4.
(c) Cho Al vào dung dịch NaOH.
(d) Nung KNO3 trong bình kín không có không khí.
(e) Cho Sn vào dung dịch HCl loãng.
(g) Nhỏ dung dịch HCl vào dung dịch NaHCO3.
Số thí nghiệm sinh ra đơn chất khí là
A. 5
B. 3
C. 4
D. 6
Dung dịch X chứa Na2CO3 0,75M và NaHCO3 0,25M. Cho từ từ đến hết 200 ml dung dịch H2SO4 vào 200 ml dung dịch X thu được 3,36 lít khí (đktc) và dung dịch Y. Cho Ba(OH)2 dư vào dung dịch Y thu được m gam kết tủa. Giá trị m là
A. 56,45 gam
B. 54,65 gam
C. 44,80 gam
D. 34,95 gam
X, Y, Z là ba dung dịch không màu, thực hiện các thí nghiệm và có kết quả theo bảng sau:
|
Chất |
X |
Y |
Z |
Ghi chú |
|
X |
(-) |
↓ |
↓/↑ |
↑: khí thoát ra; ↓: kết tủa (-): không phản ứng |
|
Y |
|
(-) |
↓ |
|
|
Z |
↓,↑ |
↓ |
(-) |
Các dung dịch X, Y, Z lần lượt là
A. NaHCO3, NaHSO4, BaCl2.
B. NaHSO4, BaCl2, Na2CO3.
C. Al2(SO4)3, BaCl2, Na2CO3.
D. FeCl2, Ba(OH)2, AgNO3.
Cho các nhận định sau:
(1) Nhôm là kim loại nhẹ, có tính khử mạnh, dẫn điện, dẫn nhiệt tốt.
(2) Các kim loại kiềm thổ tác dụng được với nước ở điều kiện thường.
(3) Trong công nghiệp, các kim loại kiềm được điều chế bằng phương pháp điện phân dung dịch.
(4) Thành phần cacbon trong gang trắng nhiều hơn trong gang xám.
(5) Trong công nghiệp, crom được dùng để sản xuất thép.
(6) Phèn chua được dùng trong ngành thuộc da, chất cầm màu trong nhuộm vải.
Số nhận định đúng là
A. 3
B. 5
C. 6
D. 4
Cho CO2 từ từ vào dung dịch hỗn hợp gồm Ca(OH)2 và KOH, ta có kết quả thí nghiệm được biểu diễn theo đồ thị dưới đây (số liệu tính theo đơn vị mol):
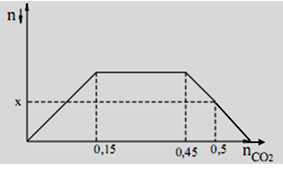
Giá trị của x là
A. 0,12.
B. 0,13.
C. 0,11.
D. 0,10.
Cho các phát biểu sau:
(1) Oxi hóa không hoàn toàn etilen là phương pháp hiện đại hiện nay để sản xuất anđehit axetic.
(2) Phenol tan ít trong nước cũng như trong etanol.
(3) Các chất metylamin, ancol etylic và natri hiđrocacbonat đều cho phản ứng với axit fomic.
(4) Phản ứng thế brom vào vòng benzen của phenol dễ hơn benzen.
(5) Khi đun nóng hỗn hợp gồm phenol và axit axetic với H2SO4 đặc làm xúc tác thu được phenyl axetat.
(6) Phenol có tính axit nên còn gọi là axit phenic nên phản ứng được với natri hiđrocacbonat.
Số phát biểu đúng là
A. 5
B. 2
C. 3
D. 4
Hãy cho biết dùng quỳ tím có thể phân biệt được dãy các dung dịch nào sau đây?
A. glyxin, lysin, axit glutamic
B. glyxin, valin, axit glutamic
C. alanin, axit glutamic, valin
D. glyxin, alanin, lysin
Tiến hành các thí nhiệm:
(1) Nhúng 1 thanh Cu và dung dịch FeCl3
(2) Nhúng thanh Al dư vào dung dịch FeCl3
(3) Nhúng thanh hợp kim Al và Cu vào dung dịch HCl loãng
(4) Nhúng thanh Ag vào dung dịch H2SO4 loãng
Số trường hợp xuất hiện ăn mòn điện hoá là
A. 1
B. 4
C. 2
D. 3
Dung dịch NaOH loãng tác dụng được với tất cả các chất thuộc dãy nào sau đây?
A. CO, H2S, Cl2, dung dịch AlCl3, C6H5OH.
B. Al2O3, CO2, dung dịch NaHCO3, dung dịch ZnCl2, NO2.
C. Dung dịch NaAlO2, Zn, S, dung dịch NaHSO4.
D. NO, dung dịch Cu(NO3)2, dung dịch NH4Cl, dung dịch HCl.