245 Bài tập tổng hợp Hóa vô cơ cực hay có lời giải (P4)
- 1Làm xong biết đáp án, phương pháp giải chi tiết.
- 2Học sinh có thể hỏi và trao đổi lại nếu không hiểu.
- 3Xem lại lý thuyết, lưu bài tập và note lại các chú ý
- 4Biết điểm yếu và có hướng giải pháp cải thiện
Cho các phát biểu sau:
(1) Để bảo vệ vỏ tàu biển làm bằng thép, người ta gắn các lá kẽm vào phần ngoài vỏ tàu chìm trong nước.
(2) Sắt có trong hemoglobin của máu, làm nhiệm vụ vận chuyển oxi, duy trì sự sống.
(3) Để chuyên chở axit sunfuric đặc, nguội người ta có thể dùng thùng sắt hoặc thùng nhôm.
(4) Trong công nghiệp, nhôm được điều chế bằng phương pháp điện phân nóng chảy AlCl3.
(5) Corinđon ở dạng tinh thể trong suốt, không màu, rất cứng, có thành phần chính là Al2O3 khan.
(6) Trong phòng thí nghiệm, để tiêu hủy Na dư thừa ta cho vào dung dịch cồn từ 90o trở lên.
Số phát biểu đúng là:
A. 5
B. 4
C. 3
D. 2
Thực hiện các thí nghiệm sau:
(1) Cho bột Al vào dung dịch NaOH (dư).
(2) Điện phân dung dịch NaCl bằng điện cực trơ, không màng ngăn xốp.
(3) Cho dung dịch KI vào dung dịch chứa Fe2(SO4)3.
(4) Dẫn luồng khí NH3 qua ống sứ chứa CrO3.
(5) Cho bột Fe vào lượng dư dung dịch FeCl3.
(6) Đốt NH3 trong không khí, có xúc tác Pt ở 850 – 900oC.
Số thí nghiệm thu được đơn chất là
A. 4
B. 5
C. 2
D. 3
Trong các thí nghiệm sau:
(1) Cho SiO2 tác dụng với axit HF.
(2) Sục khí H2S vào dung dịch FeCl3
(3) Cho khí NH3 tác dụng với CuO nung nóng.
(4) Cho K2Cr2O7 tác dụng với HCl đặc
(5) Cho Si đơn chất tác dụng với dung dịch NaOH
(6) Nung hỗn hợp quặng apatit, cát và than cốc ở 1200oC trong lò điện
(7) Cho NH4Cl vào dung dịch NaNO2 rồi đun nóng
(8) Đốt cháy hỗn hợp gồm Mg và SiO2.
Số thí nghiệm tạo ra đơn chất ở dạng khí hoặc hơi là
A. 4
B. 5
C. 6
D. 7
Dãy gồm các chất vừa tan trong dung dịch HCl, vừa tan trong dung dịch NaOH là:
A. Mg(OH)2, Al2O3, Ca(HCO3)2.
B. NaHCO3, MgO, Ca(HCO3)2.
C. NaCl, NaHCO3, Al2O3.
D. NaHCO3, ZnO, Mg(OH)2.
Có 3 kim loại X, Y, Z thỏa mãn các tính chất sau:
- X tác dụng với dung dịch HCl, không tác dụng với dung dịch NaOH và dung dịch HNO3đặc, nguội.
- Y tác dụng được với dung dịch HCl và dung dịch HNO3 đặc nguội, không tác dụng với dung dịch NaOH.
- Z tác dụng được với dung dịch HCl và dung dịch NaOH, không tác dụng với dung dịch HNO3 đặc nguội.
X, Y, Z lần lượt có thể là:
A. Fe, Mg, Zn.
B. Zn, Mg, Al.
C. Fe, Al, Mg.
D. Fe, Mg, Al.
Nhận định nào sau đây là không đúng ?
A. Phân lân nung chảy là hỗn hợp muối photphat và silicat của canxi và magie, và chỉ phù hợp với đất chua.
B. Trong phòng thí nghiệm, để điều chế nhanh một lượng nhỏ NH3, ta cho NH4Cl tác dụng với Ca(OH)2.
C. Để thu được khí CO2 sạch và khô ta dẫn lần lượt hỗn hợp (CO2, HCl, H2O) qua dung dịch NaHCO3 và H2SO4 đặc.
D. Thứ tự lực axit giảm dần là: HNO3, H3PO4, H2CO3, H2SiO3.
Cho V1 ml dung dịch NaOH 0,4M vào V2 ml dung dịch H2SO4 0,6M. Sau khi kết thúc phản ứng thu được dung dịch chỉ chứa một chất tan duy nhất. Tỉ lệ V1 : V2 là
A. 1 : 3
B. 3 : 2
C. 3 : 1
D. 2 : 3
Xét các phát biểu:
(1) SO2 và NO là những nguyên nhân chính gây hiện tượng mưa axit;
(2) CFC và NO là những nguyên nhân chính phá hủy tầng ozon của trái đất;
(3) Ngoài CO2, freon, metan và đinitơ oxit cũng tham gia đáng kể vào hiệu ứng nhà kính.
(4) Thuốc bảo vệ thực vật là một trong những nguyên nhân gây ra ô nhiễm môi trường đất và nước.
Số phát biểu đúng là
A. 3
B. 1
C. 2
D. 4
Có 5 hỗn hợp, mỗi hỗn hợp gồm 2 chất rắn có số mol bằng nhau: Na2O và Al2O3; Cu và Fe2(SO4)3; KHSO4 và KHCO3; BaCl2 và CuSO4; Fe(NO3)2 và AgNO3. Số hỗn hợp có thể tan hoàn toàn trong nước (dư) chỉ tạo ra các chất tan tốt trong nước là
A. 2
B. 4
C. 5
D. 3
Cho hỗn hợp X gồm Mg và Fe vào 200 ml dung dịch chứa Cu(NO3)2 1M và AgNO3 0,5M đến khi kết thúc các phản ứng được 24,16 gam hỗn hợp kim loại và dung dịch Y. Cho Y tác dụng với HCl dư được 0,224 lít NO (sản phẩm khử duy nhất, đktc). Phần trăm khối lượng của Fe trong hỗn hợp X có giá trị gần nhất với:
A. 28
B. 31
C. 30
D. 29
Tiến hành các thí nghiệm sau:
(a) Cho dung dịch AgNO3 vào dung dịch HBr.
(b) Cho Al2O3 vào dung dịch NaOH loãng, dư.
(c) Cho Cu vào dung dịch H2SO4 đặc, nóng, dư.
(d) Cho dung dịch Ba(OH)2 vào dung dịch NaHCO3.
(e) Cho Na vào dung dịch CuSO4 loãng, dư.
(g) Sục khí CO2 vào dung dịch Na2SiO3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là:
A. 4
B. 2
C. 5
D. 3
Rót từ từ dung dịch X chứa a mol Na2CO3 và 2a mol NaHCO3 vào dung dịch chứa 1,5a mol HCl thu được V lít khí CO2 (đktc) và dung dịch Y. Cho lượng khí CO2 ở trên từ từ cho đến hết vào dung dịch chứa b mol Ba(OH)2 ta có đồ thị sau:
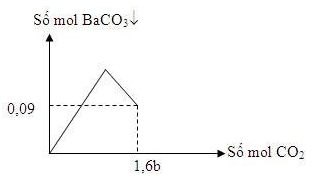
Khối lượng chất tan trong dung dịch Y là
A. 92,64.
B. 68,44
C. 82,88
D. 76,24
Cho hỗn hợp X gồm 0,24 mol FeO; 0,20 mol Mg và 0,10 mol Al2O3 tan hoàn toàn trong dung dịch chứa đồng thời 0,30 mol H2SO4 (loãng) và 1,10 mol HCl, thu được dung dịch Y và khí H2. Nhỏ từ từ dung dịch hỗn hợp Ba(OH)2 0,2M và NaOH 1,2M vào Y đến khi thu được khối lượng kết tủa lớn nhất, lọc kết tủa đem nung đến khối lượng không đổi, thu được m gam chất rắn khan. Giá trị của m gần nhất với:
A. 105,04.
B. 86,90.
C. 97,08.
D. 77,44.
Hình vẽ sau mô tả thí nghiệm điều chế khí Z ?

A. 2HCl + Zn → ZnCl2 + H2
B. K2Cr2O7 + 14HCl → 2KCl + 3Cl2 + 2CrCl3 + 7H2O
C. 4HNO3 đặc + Cu → 2NO2 + Cu(NO3)2 + 2H2O
D. Ca(OH)2 + 2NH4Cl rắn → 2NH3 + CaCl2 + 2H2O
Chất X được sử dụng trong quá trình sản xuất nhôm trong công nghiệp để giảm nhiệt đô nóng chảy của nhôm oxit, tăng khả năng dẫn điện của hỗn hợp nóng chảy... X là
A. Bôxit.
B. Đôlômit.
C. Manhetit.
D. Criolit.
Trong phòng thí nghiệm, người ta tiến hành thí nghiệm của kim loại Cu với dung dịch HNO3 đặc. Biện pháp xử lí tốt nhất để khí tạo thành khi thoát ra ngoài gây ô nhiễm môi trường ít nhất là
A. nút ống nghiệm bằng bông khô.
B. nút ống nghiệm bằng bông tẩm dung dịch Ca(OH)2.
C. nút ống nghiệm bằng bông tẩm nước.
D. nút ống nghiệm bằng bông tẩm cồn.
Tiến hành thí nghiệm như hình vẽ sau:

Chất rắn X là
A. NH4Cl.
B. Na2CO3.
C. NaCl.
D. NH4NO2.
Thí nghiệm nào sau đây có phản ứng hóa học xảy ra
A. Cho Cr2O3 vào dung dịch NaOH loãng.
B. Cho bột Fe vào dung dịch HNO3 đặc, nguội.
C. Cho dung dịch Fe(NO3)3 vào dung dịch AgNO3.
D. Nhỏ dung dịch Br2 vào dung dịch chứa NaCrO2 và NaOH.
Điều khẳng định nào sau đây là đúng?
A. Hỗn hợp gồm Na và Al2O3 có tỉ lệ mol 1 : 1 tan hết trong nước dư.
B. Cho dung dịch HCl đến dư vào dung dịch NaAlO2, thu được kết tủa keo trắng.
C. Thạch cao nung có công thức là CaSO4.H2O.
D. Các kim loại kiềm từ Li đến Cs có nhiệt độ nóng chảy tăng dần.
Có các dung dịch muối AlCl3, (NH4)2SO4, NH4NO3, MgCl2, FeCl3 đựng trong các lọ riêng biệt bị mất nhãn. Đánh dấu ngẫu nhiên 5 mẫu thử tương ứng với X, Y, Z, T, U rồi nhỏ từ từ dung dịch Ba(OH)2 vào các mẫu thử trên thì thu được kết quả trong bảng như sau:
|
Mẫu Thuốc thử |
X |
Y |
Z |
T |
U |
|
Ba(OH)2 |
Kết tủa màu nâu đỏ |
Khí mùi khai |
Kết tủa trắng, khí mùi khai |
Kết tủa trắng |
Kết tủa keo trắng, sau đó tan ra |
Các chất X, Y, Z, T, U lần lượt là
A. FeCl3, (NH4)2SO4, NH4NO3, MgCl2, AlCl3.
B. FeCl3, NH4NO3, (NH4)2SO4, AlCl3, MgCl2.
C. FeCl3, NH4NO3, (NH4)2SO4, MgCl2, AlCl3.
D. FeCl3, (NH4)2SO4, NH4NO3, AlCl3, MgCl2.
Cho hỗn hợp rắn gồm Na2O, BaO, NaHCO3, Al2O3 và NH4Cl có cùng số mol vào nước dư. Kết thúc các phản ứng thu được dung dịch X. Dung dịch X chứa các chất tan là
A. BaCl2, NaAlO2, NaOH.
B. Na2CO3, NaCl và NaAlO2.
C. AlCl3, NaCl, BaCl2.
D. NaCl và NaAlO2.
Thực hiện các thí nghiệm sau:
(a) Nhiệt phân AgNO3.
(b) Nung FeS2 trong không khí
(c) Cho Mg (dư) vào dung dịch Fe2(SO4)3.
(d) Nhiệt phân Mg(NO3)2
(e) Cho Fe vào dung dịch CuSO4 (dư).
(g) Cho Zn vào dung dịch FeCl3 (dư)
(h) Nung Ag2S trong không khí.
(h) Cho Ba vào dung dịch CuCl2 (dư)
Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc là:
A. 4
B. 3
C. 5
D. 2
Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100 ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 (dư), thu được 11,82 gam kết tủa. Giá trị của x là
A. 1,4.
B. 1,2.
C. 1,6.
D. 1,0.
Tiến hành các thí nghiệm sau :
(a) Cho NH4Cl tác dụng với NaOH.
(b) Cho NH3 tác dụng với O2 dư ở nhiệt độ cao.
(c) Nhiệt phân Cu(NO3)2.
(d) Cho HCl đặc tác dụng với dung dịch K2Cr2O7.
(e) Sục khí CO2 qua nước vôi trong dư.
(f) Điện phân dung dịch CuCl2 với điện cực trơ.
(g) Dẫn khí CO dư qua bột MgO nung nóng.
(h) Dẫn hơi nước qua than nóng đỏ.
Sau khi phản ứng kết thúc, số thí nghiệm thu được đơn chất là ?
A. 4
B. 5
C. 6
D. 7
Tiến hành các thí nghiệm sau
(1) Sục CO2 vào dung dịch Na2SiO3
(2) Cho dung dịch HCl dư vào dung dịch NaAlO2.
(3) Cho dung dịch AgNO3 vào dung dịch H3PO4.
(4) Cho NaHSO4 dư vào dung dịch Ba(HCO3)2.
(5) Sục H2S vào dung dịch Cu(NO3)2.
(6) Cho AgNO3 vào dung dịch FeCl3.
(7) Cho CrO3 vào dung dịch Ba(OH)2.
(8) Cho ure vào nước vôi trong.
(9) Cho KOH dư vào dung dịch CrCl3.
(10) Cho dung dịch H3PO4 vào dung dịch CaCl2.
Sau khi kết thúc thí nghiệm, số trường hợp thu được kết tủa là:
A. 7
B. 6
C. 9
D. 8
Điện phân dung dịch chứa m gam KCl có màng ngăn, điện cực trơ cho đến khi dung dịch chứa 2 chất tan có cùng nồng độ mol thì dừng lại thu được dung dịch X. Hấp thụ 0,2m gam CO2 vào dung dịch X thu được dung dịch Y chứa 37,0778 gam chất tan. Rót từ từ dung dịch chứa x mol HCl vào dung dịch Y thu được 0,896 lít CO2 (đktc). Giá trị của x là
A. 0,108.
B. 0,117.
C. 0,124.
D. 0,136.
Hỗn hợp X gồm a mol Mg và 2a mol Fe. Cho hỗn hợp X tác dụng với O2, sau một thời gian thu được (136a + 11,36) gam hỗn hợp Y. Cho hỗn hợp Y tác dụng với dung dịch HNO3 dư thu được 3 sản phẩm khử có cùng số mol gồm NO, N2O, NH4NO3. Cô cạn dung dịch sau phản ứng thu được 647a gam chất rắn khan. Đốt hỗn hợp X bằng V lít hỗn hợp khí Cl2 và O2 (đktc) thu được hỗn hợp Z gồm các oxit và muối clorua (không còn khí dư). Hòa tan hỗn hợp Z cần vừa đủ 0,8 lít dung dịch HCl 2M, thu được dung dịch T. Cho dung dịch T tác dụng với dung dịch AgNO3 dư thu được 354,58 gam kết tủa. Giá trị của V là:
A. 15,68
B. 14,56
C. 16,80
D. 12,32
Điều khẳng định nào sau đây là sai?
A. Cho dung dịch HCl loãng, dư vào dung dịch alanin, thấy dung dịch phân lớp
B. Nhỏ dung dịch H2SO4 đặc vào saccarozơ sẽ hoá đen
C. Cho dung dịch glucozơ vào dung dịch AgNO3/NH3 đun nóng xuất hiện kết tủa trắng bạc
D. Cho dầu ăn vào ống nghiệm đựng dung dịch NaOH dư rồi đun nóng, thấy dung dịch từ phân lớp trở nên trong suốt
Phản ứng nào sau đây có phương trình ion rút gọn: H+ + OH‒ → H2O là?
A. Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
B. HCOOH + NaOH → HCOONa + H2O
C. HCl + NaOH → NaCl + H2O
D. 2NaOH + H2S → Na2S + 2H2O
Khi tiến hành sản xuất nhôm bằng phương pháp điện phân nóng chảy Al2O3 người ta tiến hành hòa tan oxit này trong criolit nóng chảy. Phát biểu nào sau đây không đúng với mục đích sử dụng criolit?
A. Criolit nóng chảy nổi lên trên tạo lớp màng bảo vệ nhôm nằm dưới
B. Tiết kiệm điện và tạo được chất lỏng dẫn điện tốt hơn
C. Cung cấp thêm ion nhôm cho sản xuất
D. Hạ nhiệt độ nóng chảy của oxit nhôm
Trường hợp nào sau đây xảy ra phản ứng hóa học?
A. Cho dung dịch NaCl vào dung dịch Ba(HCO3)2.
B. Cho dung dịch BaCl2 vào dung dịch NaHCO3 ở nhiệt độ thường.
C. Cho Cr2O3 vào dung dịch KOH loãng.
D. Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2.
Các dung dịch riêng biệt: Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số ngẫu nhiên (1), (2), (3), (4), (5). Tiến hành một số thí nghiệm, kết quả được ghi lại trong bảng sau:
|
Dung dịch |
(1) |
(2) |
(4) |
(5) |
|
(1) |
|
Khí thoát ra |
Có kết tủa |
|
|
(2) |
Khí thoát ra |
|
Có kết tủa |
Có kết tủa |
|
(4) |
Có kết tủa |
Có kết tủa |
|
|
|
(5) |
|
Có kết tủa |
|
|
Các dung dịch (1), (3), (5) lần lượt là
A. H2SO4, NaOH, MgCl2
B. H2SO4, MgCl2, BaCl2
C. Na2CO3, NaOH, BaCl2
D. Na2CO3, BaCl2, BaCl2
Dãy chuyển hóa nào sau đây có thể thực hiện được
A. KNO3 → HNO3 → AgNO3 → NO2 → Mg(NO3)2 → MgO
B. KNO3 → HNO3 → Cu(NO3)2 → NO2 → NaNO3 → NaNO2
C. KNO3 → NaNO3 → Ba(NO3)2 → NO2 → KNO3 → KNO2
D. KNO3 → Cu(NO3)2 → NO2 → NaNO3 → NaNO2
Cho các phản ứng sau:
(1) CaC2 + H2O →
(2) Ba(HCO3)2 + H2SO4
(3) Na2S2O3 + H2SO4 (đặc) →
(4) BaCl2 + (NH4)2SO4
(5) Al4C3 + H2O →
(6) BaCO3 + H2SO4 →
Số phản ứng thu được kết tủa, đồng thời thấy khí thoát ra là
A. 5
B. 3
C. 4
D. 6
Cho 0,4 mol H3PO4 tác dụng hết với dung dịch chứa m gam NaOH, sau phản ứng thu được dung dịch X. Cô cạn X thu được 2,51m gam chất rắn. X có chứa
A. Na3PO4, NaOH
B. NaH2PO4, Na3PO4
C. Na2HPO4, Na3PO4
D. NaH2PO4, Na2HPO4
Thực hiện các thí nghiệm sau:
(1) Cho kim loại K vào dung dịch HCl.
(2) Đốt bột Al trong khí Cl2.
(3) Cho Na2CO3 vào dung dịch AlCl3.
(4) Cho NaOH vào dung dịch Mg(NO3)2.
(5) Điện phân Al2O3 nóng chảy, có mặt Na3AlF6.
Số thí nghiệm có phản ứng oxi hoá – khử xảy ra là
A. 4
B. 2
C. 3
D. 1
Cho các phản ứng sau:
(a) Nung nóng hỗn hợp rắn gồm ZnO và cacbon trong điều kiện không có không khí;
(b) Nhiệt phân muối NaNO3;
(c) Cho dung dịch FeSO4 vào dung dịch K2Cr2O7 trong H2SO4 loãng;
(d) Dẫn luồng khí NH3 qua ống sứ chứa CrO3;
(e) Cho dung dịch KI vào dung dịch FeCl3;
(f) Cho bột Zn vào lượng dư dung dịch FeCl3.
Sau khi kết thúc thí nghiệm, số trường hợp thu được đơn chất là
A. 5
B. 3
C. 4
D. 5
Cho các phát biểu sau:
(1) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+.
(2) Không thể làm mất tính cứng toàn phần của nước bằng dung dịch Na2CO3.
(3) Có thể dùng dung dịch NaOH để làm mất tính cứng tạm thời của nước.
(4) Có thể làm mất tính cứng vĩnh cửu của nước bằng dung dịch Na3PO4.
(5) Không thể dùng dung dịch HCl để làm mất tính cứng tạm thời của nước.
(6) Axit trong dịch vị dạ dày con người chủ yếu là H2SO4 loãng.
(7) Hợp kim Ag–Au bị ăn mòn điện hóa khi cho vào dung dịch HCl.
(8) Dãy Na, Rb, Mg, Al, Fe được sắp xếp theo chiều tăng dần độ cứng của các kim loại.
(9) Dãy Li, K, Cs, Ba, Ag, Os được sắp xếp theo chiều tăng dần khối lượng riêng.
(10) Kim loại có độ tinh khiết càng cao thì càng dễ bị ăn mòn.
Số phát biểu đúng là
A. 5
B. 4
C. 6
D. 3
Cho 33,8 gam hỗn hợp X gồm hai muối M(HCO3)2 và RHCO3 vào dung dịch HCl dư thấy thoát ra 6,72 lít khí. Mặt khác, cho 33,8 gam hỗn hợp X trên vào 200 ml dung dịch Y gồm Ba(OH)2 0,5M và NaOH 1,5M, sau khi kết thúc các phản ứng thu được 2,24 lít khí, dung dịch Z và m gam kết tủa. Giá trị của m là
A. 19,7
B. 25,5
C. 39,4
D. 59,1
Điện phân (với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) dung dịch chứa m gam muối M(NO3)n trong thời gian t, thấy khối lượng dung dịch giảm 43,616 gam và tại catot thoát ra kim loại M. Nếu điện phân với thời gian 1,5t, khối lượng dung dịch giảm 50,337 gam và tại catot thấy thoát ra 1,5792 lít khí (đktc). Tìm giá trị của m
A. 95,88 gam
B. 79,90 gam
C. 71,91 gam
D. 63,92 gam