310 câu Lý thuyết Crom - Sắt - Đồng có lời giải chi tiết (P6)
- 1Làm xong biết đáp án, phương pháp giải chi tiết.
- 2Học sinh có thể hỏi và trao đổi lại nếu không hiểu.
- 3Xem lại lý thuyết, lưu bài tập và note lại các chú ý
- 4Biết điểm yếu và có hướng giải pháp cải thiện
Nhận định nào sau đây không đúng?
A. Fe tan trong dung dịch HCl.
B. Fe tan trong dung dịch FeCl2.
C. Fe tan trong dung dịch CuSO4.
D. Fe tan trong dung dịch FeCl3.
Cho các kim loại sau: Na, Cu, Ag, Mg. Số kim loại tác dụng được với dung dịch FeCl3 là
A. 2.
B. 1.
C. 4.
D. 3.
Crom có số oxi hóa +3 trong hợp chất nào sau đây?
A. CrO3.
B. K2Cr2O7.
C. Cr2O3.
D. CrSO4.
Để khử ion Fe3+ trong dung dịch thành ion Fe2+ có thể dùng một lượng dư
A. kim loại Ba
B. kim loại Mg
C. kim loại Ag
D. kim loại Cu
Tiến hành phản ứng khử oxi X thành kim loại bằng khí H2 dư theo sơ đồ hình vẽ:
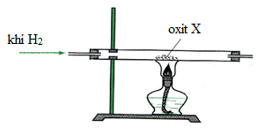
Oxit X không thể là
A. MgO.
B. CuO.
C. PbO.
D. Fe3O4.
Cho các hợp kim sau: Cu-Fe (I); Zn-Fe (II); Fe-C (III); Sn-Fe (IV). Khi tiếp xúc với dd chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn trước là
A. I, II và IV.
B. I, III và IV.
C. I, II và III.
D. II, III và IV.
Cho các chất H2S, Na2CO3, Cu, KI, Ag, SO2, CO2, Mg có bao nhiêu chất tác dụng được với dung dịch Fe2(SO4)3 dư cho sản phẩm FeSO4.
A. 6.
B. 4.
C. 7.
D. 5.
Cho vài giọt dung dịch H2S vào dung dịch FeCl3 hiện tượng xảy ra là
A. không hiện tượng gì.
B. kết tủa trắng hóa nâu.
C. dd xuất hiện kết tủa đen.
D. có kết tủa vàng
Cấu hình electron của ion Cr3+ là
A. [Ar]3d5.
B. [Ar]3d3.
C. [Ar]3d2.
D. [Ar]3d4.
Chất nào sau đây có thể oxi hóa Zn thành Zn2+?
A. Fe.
B. Ag+.
C. Al.
D. Na+.
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch AgNO3 vào dung dịch HCl dư.
(b) Cho Al2O3 vào dung dịch H2SO4 loãng dư.
(c) Cho Cu vào dung dịch HNO3 loãng dư.
(d) Cho dung dịch NaOH vào dung dịch Ca(HCO3)2.
Sau khi kết thúc các phản ứng, số trường hợp thu được chất rắn là
A. 3.
B. 1.
C. 4.
D. 2.
Từ dung dịch CuSO4 để điều chế Cu, người ta có thể dùng
A. Hg
B. Na
C. Fe
D. Ag
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y có thể là
A. Fe, Cu.
B. Cu, Fe.
C. Mg, Ag.
D. Ag, Mg.
Tiến hành các thí nghiệm sau:
(a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng;
(b) Đốt dây Fe trong bình đựng khí O2;
(c) Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3;
(d) Cho lá Zn vào dung dịch HCl;
Số thí nghiệm có xảy ra ăn mòn điện hóa là
A. 3.
B. 1
C. 4
D. 2
Cho hai phản ứng sau:
(a) 2FeBr2 + Br2 → 2FeBr3
(b) 2NaBr + Cl2 → 2NaCl + Br2.
Phát biểu đúng rút ra từ hai phản ứng trên là
A. Tính khử của Br– mạnh hơn Fe2+.
B. Tính oxi hoá của Cl2 mạnh hơn của Fe3+.
C. Tính khử của Cl– mạnh hơn Br–.
D. Tính oxi hoá của Br2 mạnh hơn Cl2.
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(b) Cho FeS vào dung dịch HCl.
(c) Cho dung dịch AgNO3 vào dung dịch NaF.
(d) Sục H2S vào dung dịch FeCl2.
(e) Sục H2S vào dung dịch CuSO4.
Trong các thí nghiệm trên, số thí nghiệm xảy ra phản ứng là
A. 3
B. 2
C. 4
D. 5
Trong số các kim loại sau: Cr, Fe, Cu, Ag. Kim loại bị thụ động hóa khi tiếp xúc với HNO3 đặc nguội hoặc H2SO4 đặc nguội là:
A. Cr, Fe, Ag.
B. Cu, Ag.
C. Cr, Fe.
D. Cr, Fe, Cu.
Cho hỗn hợp X gồm Al, Fe, Cu. Dung dịch nào sau đây khi lấy dư không thể hòa tan hết X?
A. H2SO4 loãng.
B. H2SO4 đặc nóng.
C. NaNO3 trong HCl.
D. HNO3 loãng.
Thực hiện các thí nghiệm với hỗn hợp gồm X gồm Ag và Cu. Thí nghiệm mà Cu bị oxi hóa còn Ag không bị oxi hóa là:
A. Cho X vào bình chứa một lượng dư khí O3 (ở điều kiện thường).
B. Cho X vào một lượng dư dung dịch HNO3 (đặc).
C. Cho X vào một lượng dư dung dịch HCl (không có mặt O2).
D. Cho X vào một lượng dư dung dịch FeCl3.
Phản ứng giữa FeCO3 và dung dịch HNO3 loãng tạo ra:
A. khí CO2, NO.
B. khí NO, NO2.
C. khí NO2, CO2.
D. khí N2, CO2.
Cho kim loại Fe lần lượt phản ứng với các dung dịch: FeCl3, Cu(NO3)2, AgNO3, H2SO4 đặc nguội, MgCl2. Số trường hợp xảy ra phản ứng hóa học là
A. 4
B. 1
C. 2
D. 3
Tiến hành các thí nghiệm sau
(1) Cho Zn vào dung dịch AgNO3;
(2) Cho Fe vào dung dịch Fe2(SO4)3;
(3) Cho Na vào dung dịch CuSO4;
(4) Dẫn khí CO (dư) qua bột CuO nóng.
Các thí nghiệm có tạo thành kim loại là
A. (3) và (4).
B. (2) và (3).
C. (1) và (4).
D. (1) và (4).
Phản ứng viết không đúng là
A. Fe + 2FeCl3 → FeCl2.
B. Fe + CuCl2 → FeCl2 + Cu.
C. Fe + Cl2 → FeCl2.
D. Cu + 2FeCl3 → CuCl2 + 2FeCl2.
Những mẫu hợp kim Zn-Fe vào trong cốc chứa dung dịch HCl 1M. Sau một thời gian thì
A. chỉ có chứa phần kim loại Zn bị ăn mòn.
B. chỉ có chứa phần kim loại Fe bị ăn mòn.
C. cả hai phần kim loại Zn và Fe bị ăn mòn.
D. hợp kim không bị ăn mòn.
Cho Fe3O4 tác dụng với lượng dư dung dịch H2SO4 loãng, thu được dung dịch X. Dung dịch X không tác dụng với dung dịch
A. Cu(NO3)2.
B. BaCl2.
C. K2Cr2O7.
D. NaBr.
Chất nào sau đây là chất lưỡng tính?
A. Cr(OH)3.
B. Cr(OH)2.
C. CrO.
D. CrO3.
Cho dãy biến đổi sau
X Y Z T
X, Y, Z, T là
A. CrCl2, CrCl3, NaCrO2, Na2Cr2O7.
B. CrCl2, CrCl3, Cr(OH)3, Na2CrO4.
C. CrCl2, CrCl3, NaCrO2, Na2CrO4.
D. CrCl2, CrCl3, Cr(OH)3, Na2CrO7.
Kim loại Fe tác dụng với dung dịch X loãng dư tạo muối Fe(III). Chất X là
A. HNO3.
B. CuSO4
C. H2SO4.
D. HCl.
Crom có số oxi hóa +6 trong hợp chất nào sau đây?
A. Cr(OH)2.
B. CrO3.
C. Cr2(SO4)3.
D. NaCrO2.
Cho dãy chuyển hóa sau:
Các chất X, Y, Z lần lượt là
A. K2CrO4, CrCl3, Cr(OH)3.
B. K2CrO4, CrCl3, KCrO2.
C. K2Cr2O7, CrCl3, Cr(OH)3.
D. K2Cr2O7, CrCl3, KCrO2.