Đề kiểm tra giữa học kì 2 Hóa 12 có đáp án (Mới nhất) (Đề 14)
- 1Làm xong biết đáp án, phương pháp giải chi tiết.
- 2Học sinh có thể hỏi và trao đổi lại nếu không hiểu.
- 3Xem lại lý thuyết, lưu bài tập và note lại các chú ý
- 4Biết điểm yếu và có hướng giải pháp cải thiện
D. MO.
D. Fe + CuSO4 → Cu + FeSO4.
B. oxi hoá ion kim loại thành kim loại.
D. khử ion kim loại thành nguyên tử kim loại.
Dẫn khí CO2 vào dung dịch NaOH dư, khi phản ứng kết thúc thu được dung dịch Y. Dung dịch Y có chứa
B. Na2CO3.
D. NaHCO3.
D. CaCO3.MgCO3
Nguyên liệu chính dùng để sản xuất nhôm là
D. quặng boxit.
D. chứa nhiều ion kim loại nặng.
B. có kết tủa trắng sau đó tan dần đến hết.
C. có kết tủa vàng sau đó tan dần đến hết.
D. dung dịch trong suốt từ đầu đến cuối.
Phèn chua có công thức hóa học nào sau đây?
D. KAl(SO4)2.24H2O
D. 2.
Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam kali vào 136,2 gam H2O là
D. 7,0%.
D. 3,36 gam.
D. NaOH.
Cho các phát biểu sau về nước cứng:
(a) Khi đun sôi ta có thể loại được độ cứng tạm thời của nước.
(b) Có thể dùng Na2CO3 để loại cả độ cứng tạm thời và độ cứng vĩnh cửu của nước.
(c) Dung dịch HCl hòa tan được CaCO3, MgCO3 nên dùng HCl để làm mềm nước cứng.
(d) Có thể dùng Ca(OH)2 với lượng vừa đủ để làm mềm nước cứng toàn phần.
Số phát biểu đúng là
D. 2.
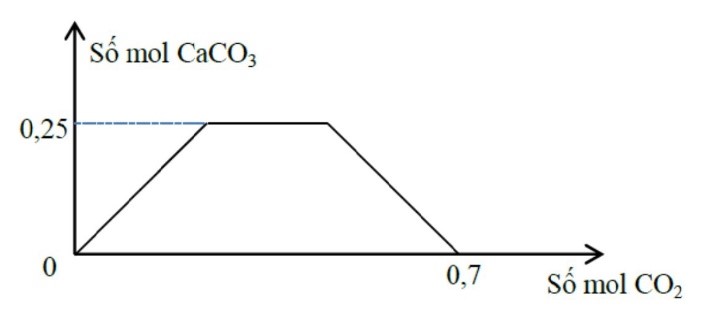
Tỉ lệ a : b tương ứng là
Khi cho từ từ đến dư dung dịch NH3 vào dung dịch AlCl3. Hiện tượng thu được là
B. có khí thoát ra, có kết tủa keo trắng.
D. có khí thoát ra.
Muối X tác dụng với dung dịch HCl có khí thoát ra, tác dụng với dung dịch NaOH có kết tủa. X là
A. Ca(HCO3)2.
B. NaHCO3, Al, NaAlO2, AlCl3
D. NaHCO3, K, Al2O3, Al(OH)3
Để phản ứng vừa đủ với 5,4 gam Al cần 100 ml dung dịch NaOH x (mol/l). Giá trị của x là
Thể tích dung dịch Ca(OH)2 0,01M tối thiểu để hấp thụ hết 0,02 mol khí CO2 là
D. 1,12 gam.
B. dung dịch NaOH.
D. H2.
D. 0,010.
A. Ion Ca2+ bị khử khi điện phân CaCl2 nóng chảy
B. Nguyên tử Ca bị oxi hoá khi Ca tác dụng với nước
C. Nguyên tử Ca bị khử khi Ca tác dụng với Cl2
D. Ion Ca2+ không bị khử khi Ca(OH)2 tác dụng với HCl
D. Na2CO3 + Ba(OH)2; (tỉ lệ mol 1:1)
D. 20,46.
Cho hỗn hợp gồm Na2O, CuO, Al2O3 có tỷ lệ mol 1:1:1 vào nước dư được chất rắn X. Dẫn H2 có dư đi qua X ở nhiệt độ cao được chất rắn Y. Y chứa
C. Cu và Al.
D. CuO.
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch NaOH vào dung dịch Ca(HCO3)2.
(b) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
(c) Đun nóng nước cứng vĩnh cửu.
(d) Cho dung dịch HCl đến dư vào dung dịch NaAlO2.
(e) Cho dung dịch Ba(OH)2 dư vào dung dịch AlCl3.
(f) Cho dung dịch NaOH vào nước cứng tạm thời.
Số thí nghiệm thu được kết tủa sau phản ứng là
Cho từ từ x mol khí CO2 vào 500 gam dung dịch hỗn hợp KOH và Ba(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
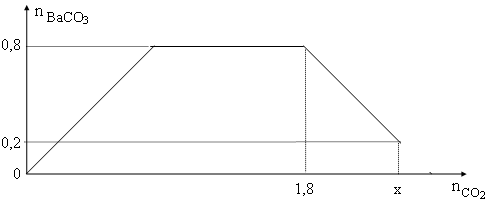
D. 42,17%.
C. Fe(NO3)2.
D. Cu(NO3)2.
D. (1) giảm (2) không đổi.
D. NaHCO3 NaOH + CO2
D. 18,0.
Hỗn hợp X gồm 0,1 mol Na2O; 0,1 mol Ba; 0,5 mol Al. Cho X vào lượng nước dư đến khi phản ứng xảy ra hoàn toàn thì thu được V lít H2 (đktc). Giá trị của V là
D. 15,68.