Đề thi cuối kì 2 Hóa 12 có đáp án (Đề 13)
- 1Làm xong biết đáp án, phương pháp giải chi tiết.
- 2Học sinh có thể hỏi và trao đổi lại nếu không hiểu.
- 3Xem lại lý thuyết, lưu bài tập và note lại các chú ý
- 4Biết điểm yếu và có hướng giải pháp cải thiện
Hỗn hợp X gồm hai muối R2CO3và RHCO3. Chia 29,80 gam X thành hai phần bằng nhau:
- Phần một tác dụng hoàn toàn với dung dịch Ba(OH)2dư thu được 35,46 gam kết tủa.
- Phần hai tác dụng hoàn toàn với dung dịch BaCl2dư, thu được 7,88 gam kết tủa.
Phần trăm của muối R2CO3 trong X là
A. 25,77 %.
B. 34,29 %.
C. 74,22 %.
D. 65,71%.
Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s1. Số hiệu nguyên tử của X là
A. 14.
B. 15.
C. 11.
D. 27.
Phương trình hóa học nào sau đây sai?
A. Cr2O3+ 2NaOH (đặc) 2NaCrO2 + H2O.
B. Cr(OH)3+ 3HClCrCl3+ 3H2O.
C. 2Cr + 3H2SO4(loãng) CrSO4+ 3H2O.
D. 2Cr + 3Cl2 2CrCl3.
Để phân biệt các dung dịch riêng biệt: NaCl, FeCl2, FeCl3, có thể dùng dung dịch
A. NaOH.
B. HNO3.
C. Na2SO4.
D. HCl.
Hiện tượng xảy ra khi cho từ từ dung dịch NaOH đến dư vào dung dịch AlCl3là:
A. lúc đầu có kết tủa keo trắng, sau kết tủa tan hết.
B. có phản ứng xảy ra nhưng không quan sát được hiện tượng.
C. xuất hiện kết tủa keo trắng và kết tủa không bị hoà tan.
D. lúc đầu có kết tủa keo trắng, sau kết tủa tan một phần.
Để phân biệt các dung dịch loãng: HCl, HNO3, H2SO4có thể dùng thuốc thử nào sau đây ?
A. Kim loại sắt và đồng.
B. Dung dịch Ba(OH)2và bột đồng kim loại .
C. Dung dịch Ca(OH)2.
D. Kim loại nhôm và sắt.
Khử hoàn toàn a gam một oxit sắt bằng cacbon oxit ở nhiệt độ cao, người ta thu được 0,84 gam sắt và 0,88 gam khí CO2. Công thức oxit sắt là
A. Fe2O3
B. FeO2
C. FeO
D. Fe3O4
Hòa tan hoàn toàn m gam hỗn hợp X gồm FeO, FeCO3và Fe3O4(trong đó Fe3O4chiếm 1/3 tổng số mol hỗn hợp) vào dung dịch HNO3loãng dư, thu được 8,96 lít (đkc) hỗn hợp khí gồm CO2và NO (sản phẩm khử duy nhất của N+5) có tỉ khối so với H2là 18,5. Phần trăm khối lượng của Fe3O4trong X có giá trị gần nhất với giá trị nào sau đây?
A. 63.
B. 45.
C. 73.
D. 55.
Để nhận biết ion Ca2+trong dung dịch ta dùng thuốc thử nào sau đây ?
A. Dung dịch HCl.
B. Dung dịch HNO3.
C. Dung dịch KCl.
Nung hỗn hợp X gồm 2,7 gam Al và m gam FeO, sau một thời gian thu được hỗn hợp Y. Để hòa tan hoàn toàn Y cần vừa đủ 300 ml dung dịch H2SO41M. Phần trăm khối lượng của Al trong X là
A. 47,25 %.
B. 42,75 %.
C. 20 %.
D. 80 %.
Kim loại Al không tan được trong dung dịch nào sau đây ?
A. HCl.
B. BaCl2.
C. Ba(OH)2.
D. NaOH.
Cho kim loại Fe lần lượt phản ứng với các dung dịch: FeCl3, Ni(NO3)2, AgNO3, H2SO4loãng. Số trường hợp xảy ra phản ứng hóa học là
A. 1.
B. 2.
C. 4.
D. 3.
Cho 6,18 gam hỗn hợp Na2CO3 và KHCO3 vào bình chứa dung dịch Ba(HCO3)2 thu được m kết tủa X và dung dịch Y. Thêm từ từ dung dịch HCl 1,0M vào bình đến khi không còn khí thoát ra thì hết 560 ml. Biết toàn bộ Y phản ứng vừa đủ với 500 ml dung dịch NaOH 1M. Phần trăm khối lượng của K2CO3 trong hỗn hợp ban đầu là
A. 23,41 %.
B. 62,16 %.
C. 41,32 %.
D. 51,46 %.
Cấu hình electron của Fe là 1s22s22p63s23p63d64s2. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố Fe ở vị trí ô thứ mấy ?
A. 8.
B. 56.
C. 4.
D. 26.
Chất nào sau đây vừa phản ứng được với dung dịch NaOH, vừa phản ứng được với dung dịch HCl?
A. Al2(SO4)3.
B. AlCl3.
C. Al(OH)3.
D. NaAlO2.
Cho các phát biểu sau:
(a) Cr và Cr(OH)3 đều có tính lưỡng tính và tính khử.
(b) Cr2O3và CrO3đều là chất rắn, màu lục, không tan trong nước.
(c) H2CrO4và H2Cr2O7đều chỉ tồn tại trong dung dịch.
(d) CrO3và K2Cr2O7đều có tính oxi hoá mạnh.
Số phát biểu đúng là
A. 2.
B. 4.
C. 3.
D. 1.
Cho các phát biểu sau:
(a) Dùng Ba(OH)2có thể phân biệt được hai dung dịch AlCl3và Na2SO4.
(b) Cho dung dịch NaOH vào dung dịch AlCl3dư, thu được kết tủa.
(c) Nhôm là kim loại nhẹ, màu trắng bạc, dẫn điện tốt, dẫn nhiệt tốt.
(d) Kim loại nhôm tan trong dung dịch H2SO4đặc, nguội.
(e) Ở nhiệt độ cao, NaOH và Al(OH)3đều không bị phân hủy.
Số phát biểu đúng là
A. 2.
B. 3.
C. 4.
D. 1.
Hợp chất Fe2O3tác dụng được với chất nào sau đây ?
A. H2O.
B. NaOH.
C. HCl.
D. AgNO3.
Chất nào sau đây làm mất tính cứng của nước cứng tạm thời?
A. NaCl.
B. Na2CO3.
C. NaNO3.
D. HCl.
Kim loại nào sau đây tan được trong nước ?
A. Cr.
B. Mg.
C. Fe.
D. K.
Cho dung dịch muối AgNO3đến dư vào dung dịch muối FeCl2, thu được kết tủa X. Cho X vào dung dịch HNO3(loãng, dư), thu được chất rắn T và khí không màu hóa nâu trong không khí. T là
A. AgCl, Ag.
B. Ag, Fe.
C. AgCl.
D. Ag.
Thí nghiệm nào sau đây không xảy ra phản ứng hóa học?
A. Cho Al2O3vào dung dịch NaOH.
B. Cho Al vào dung dịch HCl đặc, nguội.
C. Cho Al2O3vào dung dịch HCl loãng.
D. Cho kim loại Al vào dung dịch MgCl2.
Số oxi hóa của Cr trong hợp chất K2Cr2O7là
A. +6.
B. +2.
C. +12.
D. +3.
Hòa tan hoàn toàn 13,8 gam hỗn hợp X gồm Al, Fe vào dung dịch H2SO4loãng, thu được 10,08 lít khí (đktc). Phần trăm về khối lượng của Al trong X là
A. 39,13%.
B. 20,24%.
C. 76,91%.
D. 58,70%.
Các dung dịch Na2SO4và Al2(SO4)3đều không màu. Để phân biệt 2 dung dịch này có thể dùng dung dịch của chất nào sau đây ?
A. HCl
B. NaOH
C. HNO3
D. NaCl.
Để hoà tan hoàn toàn 22,80 gam FeSO4cần vừa đủ V ml dung dịch K2Cr2O70,2M trong H2SO4loãng, dư. Giá trị của V là
A. 125.
B. 300.
C. 200.
D. 250.
Cho bột Fe vào dung dịch hỗn hợp NaNO3và HCl đến khi các phản ứng kết thúc, thu được dung dịch X, hỗn hợp khí NO, H2và chất rắn không tan. Các muối trong dung dịch X là
A. FeCl2, Fe(NO3)2, NaCl, NaNO3.
B. FeCl2, NaCl.
C. FeCl3, NaCl.
D. Fe(NO3)3, FeCl3, NaNO3, NaCl.
Dãy các chất đều tác dụng được với dung dịch Ca(OH)2 là:
A. HNO3, NaCl và Na2SO4.
B. HNO3, Ca(HCO3)2 và Na2CO3.
C. HCl, H2SO4 và BaCl2
D. HNO3, Ca(HCO3)2 và KNO3.
Có thể điều chế Na, Mg, Ca bằng cách nào sau đây?
A. Dùng H2khử các oxit kim loại tương ứng
B. Điện phân nóng chảy muối clorua.
C. Điện phân dung dịch muối clorua bão hoà.
D. Dùng kali khử dd muối clorua
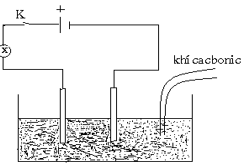
Nước vôi trong Ca(OH)2
A. Mờ dần đi sau đó vẫn sáng mờ mờ.
B. Mờ dần đi rồi sáng dần lên.
C. Mờ dần đi sau đó tắt hẳn.