Đề thi cuối kì 2 Hóa 12 có đáp án (Đề 7)
- 1Làm xong biết đáp án, phương pháp giải chi tiết.
- 2Học sinh có thể hỏi và trao đổi lại nếu không hiểu.
- 3Xem lại lý thuyết, lưu bài tập và note lại các chú ý
- 4Biết điểm yếu và có hướng giải pháp cải thiện
A. quặng pirit.
B. quặng manhetit.
C. quặng boxit.
D. quặng đôlômit.
A. 3.
B. 1.
C. 2.
D. 4.
A. 2,7 gam.
B. 1,35 gam.
C. 5,4 gam.
D. 8,1 gam.
A. Ca.
B. Fe.
C. K.
D. Na.
A. NaHCO3.
B. Al2O3.
C. AlCl3.
D. Al(OH)3.
A. Na+, K+.
B. 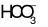 , Cl-.
, Cl-.
C. Ca2+, Mg2+.
D. 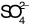 , Cl-.
, Cl-.
A. kẽm.
B. đồng.
C. chì.
D. thiếc.
A. Mg.
B. Ba.
C. Sr.
D. Ca.
A. MgCl2và FeCl3.
B. CuSO4và HCl.
C. CuSO4và ZnCl2.
D. HCl và CaCl2.
A. 8,5.
B. 2,2.
C. 2,0.
D. 6,4.
A. [Ar] 3d34s2.
B. [Ar] 3d54s1.
C. [Ar] 3d44s2.
D. [Ar] 3d6.
A. 3,36.
B. 6,72.
C. 4,48.
D. 2,24.
A. Ca và Fe.
B. Mg và Zn.
C. Na và Cu.
D. Fe và Cu.
A. CaSO4.H2O.
B. 2CaSO4.H2O.
C. CaSO4.
D. CaSO4.2H2O.
A. lục xám.
B. lục thẫm.
C. đỏ thẫm.
D. nâu đỏ.
A. 1.
B. 2.
C. 3.
D. 4.
A. Sr, K.
B. Na, Ba.
C. Be, Al.
D. Ca, Ba.
A. Hemantit nâu.
B. Hematit đỏ.
C. Pirit sắt.
D. Manhetit.
A. Hg, Al.
B. Al, Cr.
C. Hg, W.
D. W, Cr.
A. Al, Mg, Fe.
B. Fe, Al, Mg.
C. Mg, Fe, Al.
D. Fe, Mg, Al.
A. 46,4%.
B. 52,9%.
C. 59,2%.
D. 25,92%.
Chất Thuốc thử | X | Y | Z | T |
Dung dịch Ca(OH)2 | Kết tủa trắng | Khí mùi khai | Không có hiện tượng | Kêt tủa trắng, có khí mùi khai |
Nhận xét nào sau đây đúng?
A. X là dung dịch NaNO3.
B. T là dung dịch (NH4)2CO3.
C. Z là dung dịch NH4NO3.
D. Y là dung dịch KHCO3.
 X
X  Y. Biết Y là hợp chất của crom. Hai chất X và Y lần lượt là
Y. Biết Y là hợp chất của crom. Hai chất X và Y lần lượt làA. CrCl2và K2Cr2O7.
B. CrCl3và KCrO2.
C. CrCl3và K2Cr2O7.
D. CrCl3và K2CrO4.
A. NH3, SO2, CO, Cl2.
B. N2, NO2, CO2, CH4, H2.
C. NH3, O2, N2, CH4, H2.
D. N2, Cl2, O2, CO2, H2.
A. SO2, O2 và Cl2.
B. H2, NO2và Cl2.
C. H2, O2 và Cl2.
D. Cl2, O2và H2S.
A. Mg, Al, Fe, Cu.
B. MgO, Fe, Cu.
C. Mg, Fe, Cu.
D. MgO, Fe3O4, Cu.
A. 5.
B. 2.
C. 3.
D. 4.
A. 4.
B. 1.
C. 3.
D. 5.
Dung dịch X
KhíZ
Dung dịch X
Chất rắn Y
KhíZ
H2O
Dung dịch X
KhíZ
Dung dịch X
Chất rắn Y
KhíZ
H2O
Hình vẽ trên minh họa cho phản ứng nào sau đây ?
A. Zn + H2SO4(loãng) 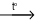 ZnSO4+ H2.
ZnSO4+ H2.
B. K2SO3(rắn) + H2SO4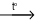 K2SO4+ SO2+ H2O.
K2SO4+ SO2+ H2O.
C. CuO (rắn) + CO 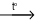 Cu + CO2.
Cu + CO2.
D. NaOH(dung dịch) + NH4Cl (rắn) 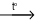 NH3+ NaCl + H2O.
NH3+ NaCl + H2O.
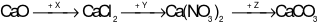 . Công thức của X, Y, Z lần lượt là:
. Công thức của X, Y, Z lần lượt là:A. HCl, AgNO3, (NH4)2CO3.
B. Cl2, HNO3, CO2.
C. HCl, HNO3, Na2CO3.
D. Cl2, AgNO3, MgCO3.
A. Al, Fe, Ag.
B. Fe, Cu, Ag.
C. Al, Cu, Ag.
D. Al, Fe, Cu.
A. 2,88.
B. 2,16.
C. 5,04.
D. 4,32.
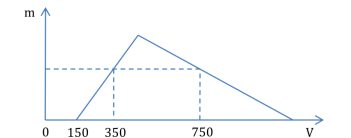
A. 10,08.
B. 3,36.
C. 1,68.
D. 5,04.
A. 0,1 và 0,075.
B. 0,05 và 0,1.
C. 0,075 và 0,1.
D. 0,1 và 0,05.
(1) Cho AgNO3vào dung dịch Fe(NO3)2.
(2) Dẫn NH3 qua ống đựng CuO nung nóng.
(3) Cho Al vào dung dịch Fe2(SO4)3 dư.
(4) Cho K vào dung dịch Cu(NO3)2.
Sau khi kết thúc phản ứng, số thí nghiệm có tạo thành kim loại là
A. 3.
B. 2.
C. 1.
D. 4.
A. Na.
B. K.
C. Rb.
D. Li.
A. Mg.
B. Zn.
C. Fe.
D. Cu.
A. 0,045.
B. 0,015.
C. 0,095.
D. 0,005.
A. 7.
B. 4.
C. 6.
D. 5.
A. 14%.
B. 15%.
C. 13%.
D. 12%.