ĐGNL ĐH Bách khoa - Vấn đề thuộc lĩnh vực hóa học - Chlorine
- 1Làm xong biết đáp án, phương pháp giải chi tiết.
- 2Học sinh có thể hỏi và trao đổi lại nếu không hiểu.
- 3Xem lại lý thuyết, lưu bài tập và note lại các chú ý
- 4Biết điểm yếu và có hướng giải pháp cải thiện
Trong tự nhiên clo có mấy đồng vị bền, là những đồng vị nào?
A. Có 2 đồng vị bền là 35Cl và 37Cl.
B. Có 2 đồng vị bền là 36Cl và 37Cl.
C. Có 3 đồng vị bền là 35Cl, 36Cl và 37Cl.
D. Có 1 đồng vị bền là 35,5Cl.
Khi sục Cl2 vào nước thu được nước clo có màu vàng nhạt. Trong nước clo có chứa các chất
A. Cl2, H2O.
B. HCl, HClO.
C. HCl, HClO, H2O.
D. Cl2, HCl, HClO, H2O.
Phản ứng hóa học giữa hiđro và clo xảy ra ở điều kiện
A. có chiếu sáng
B. nhiệt độ thấp
C. trong bóng tối.
D. trong bóng tối, ở nhiệt độ thường
Hòa tan khí Cl2 vào dung dịch KOH loãng dư, ở nhiệt độ phòng thu được dung dịch chứa
A. KCl, KClO3, Cl2.
B. KCl, KClO3, KOH.
C. KCl, KClO, KOH.
D. KCl, KClO3.
Để khử độc khí clo dư đã thoát ra trong phòng thí nghiệm, người ta dùng hóa chất nào sau đây là tối ưu nhất?
A. dung dịch NaOH.
B. khí NH3.
C. dung dịch Ca(OH)2.
D. dung dịch NaCl.
Chất được dùng để làm khô khí clo ẩm là
A. CaO.
B. Na2SO3 khan.
C. NaOH khan.
D. dung dịch H2SO4 đặc.
Nung đỏ 1 dây sắt rồi đưa nhanh vào bình chứa khí clo dư, phản ứng xảy ra hoàn toàn thu được sản phẩm là
A. FeCl2.
B. FeCl3.
C. Fe và FeCl2.
D. FeCl2 và FeCl3.
Khi mở vòi nước máy sẽ có mùi lạ hơi hắc. Đó là do nước máy còn lưu giữ vết tích của chất sát trùng. Đó chính là clo và người ta giải thích khả năng diệt khuẩn của clo là do
A. clo độc nên có tính sát trùng.
B. clo có tính oxi hóa mạnh.
C. có HClO chất này có tính oxi hóa mạnh.
D. nguyên nhân khác.
Clo có thể phản ứng được với tất cả các chất trong dãy nào sau đây ?
A. Cu, CuO, Ca(OH)2, AgNO3.
B. NaBr, NaI, NaOH.
C. ZnO, Na2SO4, Ba(OH)2.
D. Fe, Cu, O2 , N2.
Trong phản ứng Cl2 + 2KI → 2KCl + I2. Clo đóng vai trò là chất gì?
A. Chất oxi hóa.
B. Chất khử.
C. Vừa là chất oxi hóa, vừa là chất khử.
D. Môi trường.
Phương pháp điều chế khí clo trong công nghiệp là:
A. Cho HCl tác dụng với chất oxi hóa mạnh.
B. Điện phân dung dịch NaCl.
C. Điện phân dung dịch NaCl, màng ngăn xốp.
D. Phương pháp khác.
Trong phòng thí nghiệm nếu không có HCl đặc, để điều chế clo ta có thể thay thế bằng hỗn hợp nào sau đây ?
A. Hỗn hợp H2S + NaCl rắn + KMnO4.
B. Hỗn hợp H2SO4 đặc + NaCl rắn + MnO2.
C. Hỗn hợp HBr + NaCl rắn + KMnO4.
D. Hỗn hợp HI + NaCl rắn + K2Cr2O7.
Muối NaCl tồn tại chủ yếu ở dạng nào?
A. Trong lòng đất.
B.Trong cơ thể người.
C.Nước biển và muối mỏ.
D. Có nhiều ở thực vật.
Clo được dùng để làm gì?
A. Khử trùng nước sinh hoạt.
B. Tẩy trắng vải sợi, bột giấy.
C. Điều chế nước Giaven, hợp chất hữu cơ.
D. Cả A, B, C đều đúng.
Tại sao không thu khí clo qua nước?
A. Vì clo tan trong nước.
B. Vì clo nặng hơn nước.
C. Vì clo độc.
D. Vì clo nặng hơn không khí.
Cho khí clo hấp thụ hết trong dung dịch NaOH dư, đun nóng (100oC) thu được dung dịch có chứa 11,7 gam muối NaCl. Thể tích khí clo đã hấp thụ là
A. 2,240 lít.
B. 1,120 lít.
C. 3,360 lít.
D. 2,688 lít.
Dẫn hai luồng khí clo đi qua dung dịch NaOH: dung dịch 1 loãng và nguội; dung dịch 2 đậm đặc và đun nóng đến 100oC. Nếu lượng muối NaCl sinh ra trong hai dung dịch bằng nhau thì tỉ lệ thể tích clo đi qua 2 dung dịch trên theo tỉ lệ là
A. 5/6.
B. 5/3.
C. 2/1.
D. 8/3.
Cho 13,44 lít khí clo (đktc) đi qua 2,5 lít dung dịch KOH ở 100oC. Sau khi phản ứng xảy ra hoàn toàn, toàn bộ lượng KCl sinh ra cho tác dụng với dung dịch AgNO3 dư thu được 71,75 gam kết tủa. Dung dịch KOH trên có nồng độ là
A. 0,20M.
B. 0,24M.
C. 0,32M.
D. 0,48M.
Cho 21,8 gam hỗn hợp X gồm Al, Fe và Zn đốt trong khí clo dư thu được 57,3 gam hỗn hợp muối Y. Cho Y vào dung dịch AgNO3 dư thu được kết tủa có khối lượng là
A. 114,8 gam.
B.129,15 gam.
C. 143,5 gam.
D. 157,85 gam.
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị không đổi) trong hỗn hợp khí Cl2 và O2. Sau phản ứng thu được 23 gam chất rắn và thể tích khí đã phản ứng là 5,6 lít (đktc). Kim loại M là
A. Ca.
B. Be.
C. Cu.
D. Mg.
Thực hiện thí nghiệm điều chế clo theo sơ đồ sau:
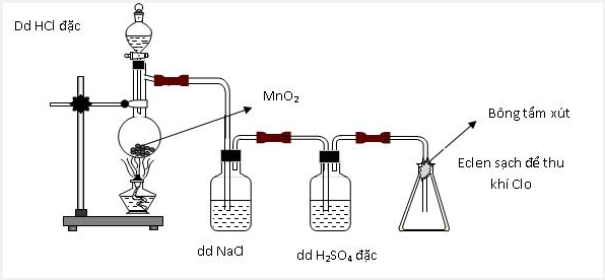
Cho các nhận định sau:
(a) Bình chứa dung dịch NaCl dùng để giữ khí HCl.
(b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước.
(c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước.
(d) Có thể thay chất rắn trong bình cầu thành thuốc tím.
Số nhận định chính xác là:
A. 1
B. 2
C. 3
D. 4
Hòa tan hoàn toàn m gam KMnO4 trong dung dịch HCl đặc, nóng thu được 4,48 lít khí Cl2 (đktc). Giá trị m là:
A. 16,24 gam
B. 12,64 gam
C. 17,4 gam
D. 1,264 gam
Thể tích khí clo (đktc) và khối lượng natri cần dung để điều chế 4,68 gam NaCl, hiệu suất phản ứng 80% là (cho Na = 23 ; Cl = 35,5)
A. 22,4 lit và 23 gam
B. 2,24 lit và 2,3 gam
C. 11,2 lit và 2,3 gam
D. 1,12 lít và 2,3 gam
Cho m gam KMnO4 tác dụng với dung dịch HCl đặc dư thu được dung dịch X chứa HCl dư và 28,07 gam hai muối và V lít khí Cl2 (đktc). Lượng khí Cl2 sinh ra oxi hóa vừa đủ 7,5 gam hỗn hợp gồm Al và kim loại M có có tỉ lệ mol Al : M = 1: 2. Kim loại M là
A. Ca
B. Mg
C. Fe
D. Cu
Đun nóng 48,2 gam hỗn hợp X gồm KMnO4 và KClO3, sau một thời gia thu được 43,4 gam hỗn hợp chất rắn Y. Cho Y tác dụng hoàn toàn với dung dịch HCl đặc, sau phản ứng thu được 15,12 lít Cl2(đktc) và dung dịch gồm MnCl2, KCl và HCl dư.Số mol HCl phản ứng là
A. 1,9.
B. 2,4.
C. 2,1.
D. 1,8.
Hấp thụ hết V lít khí Cl2 (đktc) vào 600 ml dung dịch NaOH 0,6M (ở nhiệt độ thường) thu được dung dịch Y chứa 3 chất tan có cùng nồng độ mol. Giá trị của V là
A. 5,376.
B. 2,688.
C. 4,032.
D. 1,344.
Dẫn 2 luồng khí clo đi qua 2 dung dịch KOH: dung dịch thứ nhất loãng và nguội, dung dịch thứ 2 đậm đặc và đun nóng ở 1000 C. Nếu lượng muối KCl sinh ra trong 2 dung dịch bằng nhau thì tỷ lệ thể tích khí clo đi qua dung dịch KOH thứ nhất và dung dịch thứ 2 là:
A. 5/3.
B. 3/5.
C. 3/1.
D. 1/3.
Cho 25 gam nước clo vào một dung dịch có chứa 2,5 gam KBr thấy dung dịch chuyển sang màu vàng đậm và KBr vẫn còn dư. Sau thí nghiệm, nếu cô cạn dung dịch thì còn lại 1,61 gam chất rắn khan. Biết hiệu suất phản ứng là 100%, nồng độ % của nước clo là
A. 2,51%
B. 2,84%
C. 3,46%
D. 3,15%
Cho 10,8g kim loại R tác dụng hết với Cl2 tạo thành 53,4 gam muối. Kim loại R là
A. Al
B. Fe
C. Zn
D. Mg