ĐGNL ĐH Bách khoa - Vấn đề thuộc lĩnh vực hóa học - Phản ứng trao đổi ion trong dung dịch
- 1Làm xong biết đáp án, phương pháp giải chi tiết.
- 2Học sinh có thể hỏi và trao đổi lại nếu không hiểu.
- 3Xem lại lý thuyết, lưu bài tập và note lại các chú ý
- 4Biết điểm yếu và có hướng giải pháp cải thiện
A. H2SO4, Na2CO3, BaCl2, Na2SO4
B.H2SO4, HCl, NaCl, NaNO3
C. Ba(OH)2, NaNO3, Na2CO3, BaCl2
D. NaOH, NaNO3, Na2CO3, HCl
A.
B.
C.
D.
A.
B.
C.
D.
(1) (NH4)2SO4 + BaCl2
(2) CuSO4 + Ba(NO3)2
(3) Na2SO4 + BaCl2
(4) H2SO4 + BaSO3
(5) (NH4)2SO4 + Ba(OH)2
(6) Fe2(SO4)3 + Ba(NO3)2
Các phản ứng đều có cùng phương trình ion rút gọn là
A. (1), (2), (3), (6).
B. (1), (3), (5), (6).
C. (2), (3), (4), (6).
D. (3), (4), (5), (6).
Ion cùng tồn tại với các ion sau trong một dung dịch:
A. NH4+, Na+, K+.
B. Cu2+, Mg2+, Al3+.
C. Fe2+, Zn2+, Al3+ .
D. Fe3+, HSO4-
A. AlCl3 và CuSO4.
B. NH3 và AgNO3.
C. Na2ZnO2 và HCl.
D. NaHSO4 và NaHCO3.
A. 4
B. 5
C. 2
D. 3
1) NaHSO4 + NaHSO3
2) Na3PO4 + K2SO4
3) AgNO3 + Fe(NO3)2
4) C6H5ONa + H2O
5) CuS + HNO3
6) BaHPO4 + H3PO4
7) NH4Cl + NaNO2 (đun nóng)
8) Ca(HCO3)2 + NaOH
9) NaOH + Al(OH)3
10) MgSO4 + HCl.
Số phản ứng xảy ra là
A. 8
B. 5
C. 7
D. 6
A. 4
B.6
C.3
D. 5
A. 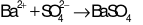
B. 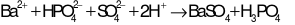
C. 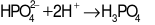
D. 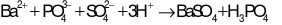
A. KNO3.
B. AgNO3.
C. NaOH.
D. Na2CO3.
A. x + 2z = y + 2t.
B. z + 2x = y + t.
C. x + 2y = z + 2t.
D. x + 2y = z + t.
A. 0,1
B.1
C.10
D. 100
A. C và CuO
B. CO2 và NaOH.
C. CO và Fe2O3.
D. C và H2O.
A. Al2(SO4)3 và ZnSO4.
B. Al2(SO4)3 và NaCl.
C. Al2(SO4)3 và CuSO4.
D. ZnSO4 và Na2SO4.
(a) Cho dung dịch Ba(HCO3)2 vào dung dịch NaHSO4.
(b) Cho Na vào dung dịch FeCl2 dư.
(c) Cho dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2.
(d) Sục khí CO2 dư vào dung dịch hỗn hợp NaOH và Ba(OH)2.
(e) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được cả kết tủa và khí là
A. 5.
B. 2.
C. 3.
D. 4.
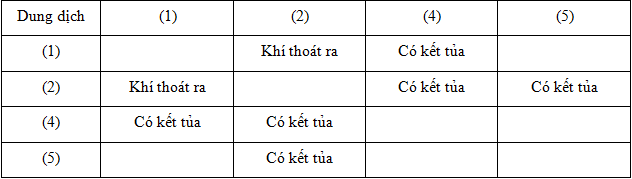
Các dung dịch (1), (3), (5) lần lượt là
A. H2SO4, NaOH, MgCl2.
B. Na2CO3, NaOH, BaCl2.
C. H2SO4, MgCl2, BaCl2.
D. Na2CO3, BaCl2, BaCl2.
Hỗn hợp X gồm Na và Ba có tỉ lệ mol 1 : 1. Hòa tan một lượng X vào nước được 3,36 lít H2 (đktc) và dung dịch Y. Cho 4,48 lít CO2 hấp thụ hết vào dung dịch Y thì thu được m gam kết tủa. Giá trị của m là:
A. 1,97 gam.
B. 39,4 gam.
C. 19,7 gam.
D. 3,94 gam.
A. 5,064
B. 20,504
C. 25,412
D. 4,908
A. 32,3
B. 38,6
C. 46,3
D. 27,4
A. 0,58 hoặc 1,62
B. 1,52 hoặc 0,48
C. 0,18 hoặc 0,58
D. 0,18 hoặc 1,22
A. 0,2M
B. 0,2M; 0,6M
C. 0,2M, 0,4M
D. 0,2M, 0,5M
A. 1,0.
B. 0,25.
C. 0,75.
D. 0,5.
A. 0,16M
B. 0,4M
C. 0,12M
D. 0,8M
Cho hỗn hợp X gồm x mol FeS2 và 0,025 mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại và giải phóng khí NO duy nhất. Giá trị của x là
A. 0,045
B. 0,075
C. 0,050
Phần 1: Hòa tan hoàn toàn bằng dung dịch HCl dư thu được 1,792 lít H2 (đktc).
Phần 2: Nung trong không khí dư, thu được 2,84 gam hỗn hợp rắn chỉ gồm các oxit.
Khối lượng hỗn hợp X là:
A. 1,56 gam
B. 2,40 gam
C. 1,80 gam
D. 3,12 gam
A. 0,20 lít
B. 0,24 lít
C. 0,30 lít
D. 0,40 lít
A. 3,94 gam
B. 5,91 gam
C. 7,88 gam
D. 1,71 gam
A. 4,215 gam
B. 5,296 gam
C. 6,761 gam
D. 7,015 gam