ĐGNL ĐH Bách khoa - Vấn đề thuộc lĩnh vực hóa học - Sự điện li
- 1Làm xong biết đáp án, phương pháp giải chi tiết.
- 2Học sinh có thể hỏi và trao đổi lại nếu không hiểu.
- 3Xem lại lý thuyết, lưu bài tập và note lại các chú ý
- 4Biết điểm yếu và có hướng giải pháp cải thiện
A. Phân tử saccarozơ không có tính dẫn điện
B.Phân tử saccarozơ không có khả năng phân li thành ion trong dung dịch
C. Phân tử saccrozơ không có khả năng hiđrat hoá với dung môi nước
D. Tất cả các lí do trên
A. Môi trường điện li.
B. Dung môi không phân cực.
C. Dung môi phân cực.
D. Tạo liên kết hiđro với các chất tan.
A. HNO3
B. HClO
C. CH3COOH
D. HF
A. HCl
B. HF
C.HI
D. HBr
A. NaCl 2,0.10-3 M
B. NaCl 2,0.10-2 M
C. NaCl 1,0.10-1 M
D. NaCl 1,0.10-3 M
A. 1
B. 2
C. 3
D. 4
A. H+, CH3COO-.
B. H+, CH3COO-, H2O.
C. CH3COOH, H+, CH3COO-, H2O.
D. CH3COOH, CH3COO-, H+.
Phương trình điện li viết đúng là
A. NaCl → Na2++ Cl2-
B. Ca(OH)2 → Ca2+ + 2OH-
C. C2H2OH → C2H5+ + OH-
A. Hoà tan NaCl vào nước.
B. Hoà tan NaCl vào dung dịch axit vô cơ loãng.
C. Nung NaCl ở nhiệt độ cao.
D. Hoà tan NaCl vào rượu etylic.
A. H2SO4, Cu(NO3)2, CaCl2, H2S
B. HCl, H3PO4, Fe(NO3)3, NaOH
C. HNO3, CH3COOH, BaCl2, KOH
D. H2SO4, MgCl2, Al2(SO4)3, Ba(OH)2
A. H2S, H2SO3, H2SO4
B. H2CO3, H3PO4, CH3COOH, Ba(OH)2
C. H2S, CH3COOH, HClO
D. H2CO3, H2SO3, HClO, Al2(SO4)3
A. 5
B. 6
C. 7
D. 8
A. Chỉ có hợp chất ion mới bị điện li khi hoà tan trong nước.
B.Độ điện li chỉ phụ thuộc vào bản chất chất điện li.
C.Độ điện li của chất điện li yếu có thể bằng 1.
D. Với chất điện li yếu, độ điện li bị giảm khi nồng độ tăng.
A. Hằng số phân li của axit (Ka) giảm.
B. Ka tăng.
C. Ka không đổi.
D. Không xác định được.
A. 2; 2.
B. 3; 2.
C. 1; 4.
D. 3: 1.
(1) Những chất điện li mạnh là các axit mạnh như HCl, HNO3, H2SO4…; các bazơ mạnh như NaOH, KOH, Ba(OH)2… và hầu hết các muối.
(2) Dãy các chất H2S, H2CO3, H2SO3 là các chất điện li yếu.
(3) Muối là hợp chất khi tan trong nước chỉ phân li ra cation kim loại và anion gốc axit.
(4) Nước cất có khả năng dẫn điện tốt do nước có thể phân li ra ion H+ và OH-.
Số nhận xét đúng là?
A. 1
B. 4
C. 2
D. 3
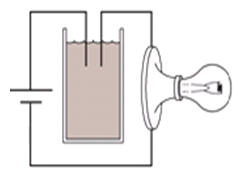
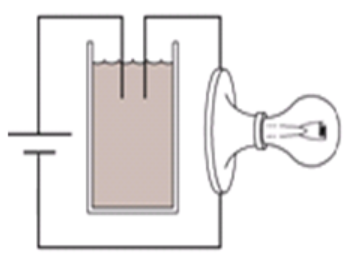
Ban đầu trong cốc chứa nước vôi trong. Sục rất từ từ CO2 vào cốc cho tới dư. Hỏi độ sáng của bóng đèn thay đổi như thế nào?
A. Giảm dần đến tắt rồi lại sáng tăng dần.
B. Tăng dần rồi giảm dần đến tắt.
C. Tăng dần.
D. Giảm dần đến tắt.
A. Sự điện li là sự phân li ra ion của các chất khi tan trong nước hoặc ở trạng thái nóng chảy
B. Dung dịch các chất điện li dẫn được điện
C. Chất khi tan trong nước hoặc ở trạng thái nóng chảy phân li thành ion gọi là chất điện li
D. Chất điện li mạnh là chất tan hoàn toàn trong nước
Có 4 dung dịch: Natri clorua, rượu etylic (C2H5OH), axit axetic (CH3COOH), kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
A. NaCl < C2H5OH < CH3COOH < K2SO4
B. C2H5OH < CH3COOH < NaCl < K2SO4
C. C2H5OH < CH3COOH < K2SO4 < NaCl
D. CH3COOH < NaCl < C2H5OH < K2SO4
A. 0,2 ml
B. 0,4 ml
C. 0,6 ml
D. 0,8 ml
A. 0,2 lít
B. 0,1 lít
C. 0,4 lít
D. 0,8 lít
A. KCl.
B. CH3COOK.
C. CH3COOH.
D. HCl.
A. 0,2M; 0,15M.
B. 0,3M; 0,2M.
C. 0,2M; 0,3M.
D. 0,3M và 0,15M.
A. 4M
B. 1M
C. 2M
D. 0,5M
A. 0,2ml
B. 0,4ml
C. 0,6ml
D. 0,8ml
A. [H+] = [Cl-] = 0,01M
B. [H+] = [Cl-] =1,0.10-4M
C. [H+] = [Cl-] = 1,0M
D. [H+] = 0,01M; [Cl-] = 1,0.10-4M
(1) Những chất điện li mạnh là các axit mạnh như HCl, HNO3, H2SO4…; các bazơ mạnh như NaOH, KOH, Ba(OH)2… và hầu hết các muối.
(2) Dãy các chất H2S, H2CO3, H2SO3 là các chất điện li yếu.
(3) Muối là hợp chất khi tan trong nước chỉ phân li ra cation kim loại và anion gốc axit.
(4) Nước cất có khả năng dẫn điện tốt do nước có thể phân li ra ion H+ và OH-.
Số nhận xét đúng là?
A. 1.
B. 4.
C. 2.
D. 3.