Lý thuyết Liên kết ion (Cánh diều 2024) Hóa 10
Tóm tắt lý thuyết Hóa 10 Bài 10: Liên kết ion ngắn gọn, chính xác sách Cánh diều sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa 10.
Lý thuyết Hóa học lớp 10 Bài 10: Liên kết ion
A. Lý thuyết Liên kết ion
I. Khái niệm và sự hình thành liên kết ion
1. Khái niệm
- Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Ví dụ: Liên kết ion trong hợp chất NaCl tạo bởi lực hút tính điện giữa cation Na+ và anion Cl-.
Na+ + Cl- → NaCl
- Liên kết ion cũng có thể được hình thành từ ion đa nguyên tử.
Ví dụ các quá trình:
NH+4 + NO−3 →NH4NO3
Na+ + NO−3 → NaNO3
- Các hợp chất được tạo nên từ cation (ion mang điện tích dương) và anion (ion mang điện tích âm) gọi là hợp chất ion.
Lưu ý: Theo quy ước, điện tích của ion được viết số trước, dấu (+ hoặc -) sau để tránh nhầm lẫn với số oxi hóa.
Ví dụ: NO−3, PO3−4, CO2−3
2. Sự hình thành liên kết ion từ phản ứng giữa các nguyên tử
- Quá trình hình thành liên kết ion diễn ra như sau:
+ Hình thành các ion trái dấu từ các quá trình nguyên tử kim loại nhường electron (tạo thành cation) và nguyên tử phi kim nhận electron (tạo thành anion) theo quy tắc octet.
+ Các ion trái dấu hút nhau bằng lực hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion. Các ion trái dấu kết hợp với nhau theo tỉ lệ sao cho tổng điện tích của các ion trong hợp chất phải bằng 0.
Ví dụ: Quá trình hình thành liên kết ion trong phân tử NaCl:
Nguyên tử Na nhường 1 electron ở lớp electron ngoài cùng cho nguyên tử Cl để tạo thành ion dương Na+. Nguyên tử Cl nhận vào lớp electron ngoài cùng 1 electron của nguyên tử Na để tạo thành ion âm Cl-. Hai ion Na+ và Cl- được tạo thành mang điện tích ngược dấu hút nhau để hình thành liên kết ion trong phân tử NaCl.
Na+ + Cl- → NaCl
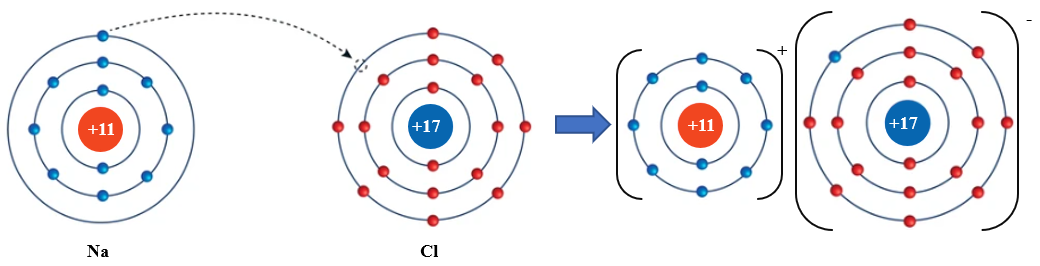
Hình 10.1. Quá trình hình thành liên kết ion trong phân tử NaCl
Nhận xét: Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình.
II. Tinh thể ion
Ở điều kiện thường, các hợp chất ion tồn tại ở dạng tinh thể, đó là các chất rắn mà sự sắp xếp các cation và anion trong không gian tuân theo một trật tự nhất định tạo nên tinh thể ion.
1. Khái niệm
- Tinh thể ion là loại tinh thể được tạo nên bởi các cation và anion.
Ví dụ: Tinh thể muối ăn (NaCl) được hình thành từ các ion Na+ và Cl- sắp xếp cạnh nhau một cách luân phiên.
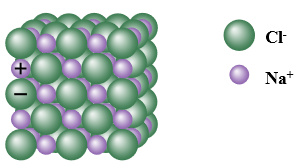
Hình 10.2. Mô hình cấu trúc tinh thể NaCl
2. Đặc điểm của hợp chất ion
- Ở điều kiện thường, các hợp chất ion thường là tinh thể rắn, có nhiệt độ nóng chảy và nhiệt độ sôi cao.
Ví dụ: NaCl nóng chảy ở 801oC, sôi ở 1465oC; CaO nóng chảy ở 2572oC, sôi ở 2850oC.
- Giải thích: Các phần tử tạo nên hợp chất ion là các cation và anion. Chúng hút nhau bằng lực hút tĩnh điện. Do vậy, các phần tử này không chuyển động tự do được.
B. Trắc nghiệm Liên kết ion
Câu 1. So sánh nào dưới đây là đúng?
A. Bán kính nguyên tử K bằng bán kính ion K+
B. Bán kính nguyên tử K lớn hơn bán kính ion K+
C. Bán kính nguyên tử K nhỏ hơn bán kính ion K+
D. Bán kính nguyên tử K lớn hơn hoặc bằng bán kính ion K+
Đáp án: B
Giải thích:
Nguyên tử K (Z = 19): [Ar]4s1 có 4 lớp electron.
K ⟶ K+ + 1e
Ion K+ (Z = 19): [Ar] có 3 lớp electron.
Do đó bán kính nguyên tử K lớn hơn bán kính ion K+
Câu 2. Liên kết ion là loại liên kết phổ biến trong
A. các hợp chất được tạo nên từ kim loại điển hình và phi kim điển hình
B. các hợp chất được tạo nên từ 2 phi kim điển hình
C. các hợp chất được tạo nên từ 2 kim loại điển hình
D. các đơn chất
Đáp án: A
Giải thích: Liên kết ion là loại liên kết phổ biến trong các hợp chất được tạo nên từ kim loại điển hình và phi kim điển hình
Câu 3. Cho ion Al3+ và SO42-. Công thức của hợp chất ion được tạo thành từ 2 ion đã cho là
A. AlSO4
B. Al3(SO4)2
C. Al2(SO4)3
D. Al2SO4
Đáp án: C
Giải thích:
Công thức của hợp chất ion được tạo thành từ 2 ion đã cho có dạng: Alx(SO4)y
Tổng điện tích của các ion trong hợp chất bằng 0 nên ta có:
3x + (-2)y=0
⇒3x=2y
⇒ Lấy x = 2; y = 3
Vậy công thức là: Al2(SO4)3
Câu 4. Quá trình hình thành liên kết ion trong phân tử CaO là
A. Ca ⟶ Ca2+ + 2e; O + 2e ⟶ O2−; Ca2+ + O2−⟶ CaO
B. Ca ⟶ Ca+ + 1e; O + 1e ⟶ O−; Ca+ + O−⟶ CaO
C. O ⟶ O2+ + 2e; Ca + 2e ⟶ Ca2−; O2+ + Ca2−⟶ CaO
D. O ⟶ O+ + 1e; Ca + 1e ⟶ Ca−; O+ + Ca−⟶ CaO
Đáp án: A
Giải thích:
Ca (Z = 20): [Ar]4s2 có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
O (Z = 8): [He]2s22p4 có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Quá trình hình thành liên kết ion:
Ca ⟶ Ca2+ + 2e
O + 2e ⟶ O2−
Ca2+ + O2−⟶ CaO
Câu 5. Quá trình hình thành liên kết ion trong phân tử MgCl2 là
A. Mg ⟶ Mg2+ + 2e; Cl + 2e ⟶ Cl2−; Mg2+ + Cl2−⟶ MgCl2
B. Mg ⟶ Mg2+ + 2e; Cl + 1e ⟶ Cl−; Mg2+ + Cl−⟶ MgCl2
C. Mg ⟶ Mg2+ + 2e; Cl + 1e ⟶ Cl−; Mg2+ + 2Cl−⟶ MgCl2
D. Mg ⟶ Mg+ + 1e; Cl + 2e ⟶ Cl2−; Mg+ + Cl2−⟶ MgCl2
Đáp án: C
Giải thích:
Mg (Z = 12): [Ne]3s2 có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Cl (Z = 17): [Ne]3s23p5 có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Quá trình hình thành liên kết ion:
Mg ⟶ Mg2+ + 2e
Cl + 1e ⟶ Cl−
Mg2+ + 2Cl− ⟶ MgCl2
Câu 6. Cho hợp chất ion A2O3. Hợp chất này được tạo thành từ các ion là
A. A2+ và O2−
B. A2+ và O3−
C. A3+ và O2−
D. A+ và O−
Đáp án: C
Giải thích:
O (Z = 8): [He]2s22p4 có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
O + 2e ⟶ O2−
Gọi điện tích của A là x
Tổng điện tích của các ion trong hợp chất bằng 0 nên ta có:
2x + (-2).3 = 0
x = 3
Hợp chất A2O3 được tạo thành từ các ion làA3+ và O2−
Câu 7. Phát biểu nào sau đây là đúng?
A. Liên kết ion chỉ có trong đơn chất
B. Liên kết ion chỉ có trong hợp chất
C. Liên kết ion có cả trong đơn chất và hợp chất
D. Cả A, B, và C đều sai.
Đáp án: B
Giải thích:
Liên kết ion được hình thành bởi lực hút tỉnh điện giữa ion dương (hình thành từ kim loại) và ion âm (hình thành từ phi kim).
⇒ Phân tử chứa liên kết ion được hình thành từ kim loại và phi kim điển hình.
⇒ Liên kết ion chỉ có trong hợp chất.
Câu 8. Liên kết ion trong hợp chất NaCl tạo bởi lực hút tĩnh điện giữa
A. cation Na2+ và anion Cl2−
B. cation Na+ và anion Cl−
C. cation Cl+ và anion Na−
D. cation Cl2+ và anion Na2−
Đáp án: B
Giải thích:
Na (Z = 11): [Ne]3s1 ⇒ có 1 electron lớp ngoài cùng ⇒ xu hướng nhường 1 electron để trở thành caction Na+
Cl (Z = 17): [Ne]3s23p5 ⇒ có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để trở thành anion Cl−
Liên kết ion trong hợp chất NaCl tạo bởi lực hút tĩnh điện giữa cation Na+ và anion Cl−.
Câu 9. Hợp chất ion nào dưới đây chỉ được tạo nên từ các ion đơn nguyên tử?
A. KCl
B. NaNO3
C. NH4NO3
D. KOH
Đáp án: A
Giải thích:
K+ + Cl−⟶ KCl
⇒ KCl là hợp chất ion chỉ được tạo nên từ các ion đơn nguyên tử.
Na+ + NO3−⟶ NaNO3
⇒ NaNO3 là hợp chất ion được tạo nên từ ion đơn nguyên tử Na+ và ion đa nguyên tử NO3-.
NH4+ + NO3−⟶ NH4NO3
⇒ NH4NO3 là hợp chất ion được tạo nên từ các ion đa nguyên tử.
K+ + OH−⟶ KOH
⇒ KOH là hợp chất ion được tạo nên từ ion đơn nguyên tử K+ và ion đa nguyên tử OH-.
Câu 10. Hợp chất ion nào dưới đây được tạo nên từ các ion đa nguyên tử?
A. NaCl
B. MgO
C. K2O
D. CaCO3
Đáp án: D
Giải thích:
Na+ + Cl−⟶ NaCl
⇒ NaCl là hợp chất ion chỉ được tạo nên từ các ion đơn nguyên tử.
Mg2+ + O2−⟶ MgO
⇒ MgO là hợp chất ion chỉ được tạo nên từ các ion đơn nguyên tử.
2K+ + O2−⟶ K2O
⇒ K2O là hợp chất ion chỉ được tạo nên từ các ion đơn nguyên tử.
Ca2+ + CO32−⟶ CaCO3
⇒ CaCO3 được tạo nên từ ion đa nguyên tử là CO32-.
Câu 11. Cấu hình electron của anion S2− (Z = 16) là
A. [Ne]3s23p4
B. [Ne]3s23p6
C. [Ne]
D. [Ne]3s23p2
Đáp án: B
Giải thích:
Cấu hình electron của nguyên tử S (Z=16): [Ne]3s23p4
S + 2e ⟶ S2−
Cấu hình electron của anion S2− (Z = 16) là: [Ne]3s23p6
Câu 12. Cấu hình electron của cation Li+ (Z = 3) là
A. [He]2s1
B. [He]2s2
C. [He]2s22p6
D. [He]
Đáp án: D
Giải thích:
Cấu hình electron của nguyên tử Li (Z=3): [He]2s1
Li ⟶ Li+ + 1e
Cấu hình electron của cation Li+ (Z = 3) là: [He]
Câu 13. Anion X3− có cấu hình electron 1s22s22p63s23p6. Cấu hình electron nguyên tử của X là
A. 1s22s22p63s23p3
B. 1s22s22p63s23p6
C. 1s22s22p63s23p63d14s2
D. 1s22s22p6
Đáp án: A
Giải thích:
Anion X3− có cấu hình electron 1s22s22p63s23p6
Mà X + 3e → X3−
Nên cấu hình electron nguyên tử của X là 1s22s22p63s23p3.
Câu 14. Cho các tính chất dưới đây:
(1) Tồn tại ở thể khí trong điều kiện thường.
(2) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(3) Thường tồn tại ở thể rắn trong điều kiện thường.
(4) Có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Tính chất điển hình của hợp chất ion là
A. (1), (3)
B. (2), (4)
C. (1), (4)
D. (2), (3)
Đáp án: D
Giải thích:
Tính chất điển hình của hợp chất ion là
(2) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(3) Thường tồn tại ở thể rắn trong điều kiện thường.
Câu 15. Ở điều kiện thường, các hợp chất ion thường tồn tại ở dạng
A. chất lỏng
B. chất khí
C. tinh thể rắn
D. rắn, lỏng hoặc khí
Đáp án: C
Giải thích: Ở điều kiện thường, các hợp chất ion thường tồn tại ở dạng tinh thể rắn.
Bài giảng Hóa học 10 Bài 10: Liên kết ion - Cánh diều