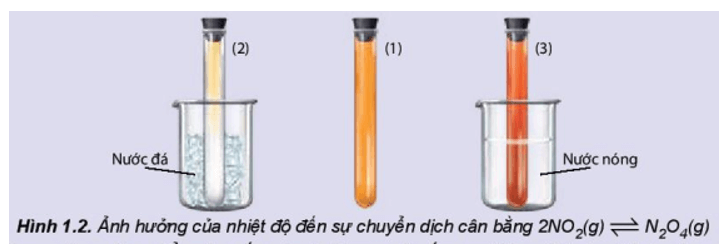
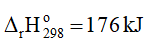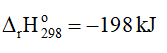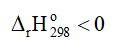Thí nghiệm 1 trang 10 Hóa học 11: Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
2NO2(g) ⇌ N2O4(g)
(màu nâu đỏ) (không màu)
Chuẩn bị: 3 ống nghiệm chứa khí NO2 nút kín có màu giống nhau, cốc nước đá, cốc nước nóng.
Tiến hành:
- Ống nghiệm (1) để so sánh.
- Ngâm ống nghiệm (2) vào cốc nước đá trong khoảng 1 – 2 phút.
- Ngâm ống nghiệm (3) vào cốc nước nóng trong khoảng 1 – 2 phút.
Lưu ý: NO2 là một khí độc, chú ý nút kín ống nghiệm.
Quan sát sự thay đổi màu sắc của khí trong các ống nghiệm và hoàn thành vào vở theo mẫu bảng sau:
Giải Hóa Học 11 (Kết nối tri thức) Bài 1: Khái niệm về cân bằng hóa học
Câu hỏi 7 trang 10 Hóa học 11: Ammonia (NH3) được điều chế bằng phản ứng: N2(g) + 3H2(g) ⇌ 2NH3(g)
Ở toC, nồng độ các chất ở trạng thái cân bằng là:
[N2] = 0,45 M; [H2] = 0,14 M; [NH3] = 0,62 M.
Tính hằng số cân bằng KC của phản ứng trên tại t oC.
Giải Hóa Học 11 (Kết nối tri thức) Bài 1: Khái niệm về cân bằng hóa học
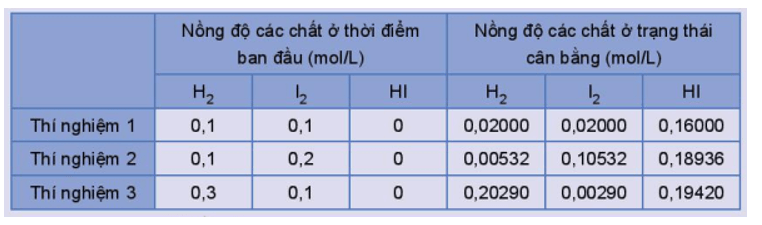
Hoạt động trang 9 Hóa học 11: Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g)
Thực hiện phản ứng trên ở trong bình kín, ở nhiệt độ 445 oC với các nồng độ ban đầu khác nhau. Số liệu về nồng độ các chất ở thời điểm ban đầu và trạng thái cân bằng trong các thí nghiệm được trình bày trong Bảng 1.2.
Bảng 1.2. Nồng độ các chất của phản ứng H2(g) + I2(g) ⇌ 2HI(g) ở thời điểm ban đầu và ở trạng thái cân bằng.
Tính giá trị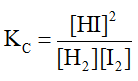
Giải Hóa Học 11 (Kết nối tri thức) Bài 1: Khái niệm về cân bằng hóa học
Câu hỏi 5 trang 9 Hóa học 11: Cho các nhận xét sau:
a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
b) Ở trạng thái cân bằng, các chất không phản ứng với nhau.
c) Ở trạng thái cân bằng, nồng độ các chất sản phẩm luôn lớn hơn nồng độ các chất đầu.
d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Các nhận xét đúng là
A. (a) và (b).
B. (b) và (c).
C. (a) và (c).
D. (a) và (d).
Giải Hóa Học 11 (Kết nối tri thức) Bài 1: Khái niệm về cân bằng hóa học
Câu hỏi 4 trang 9 Hóa học 11: Cho phản ứng: 2HI(g) ⇌ H2(g) + I2(g)
a) Vẽ dạng đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian.
b) Xác định trên đồ thị thời điểm phản ứng trên bắt đầu đạt đến trạng thái cân bằng.
Giải Hóa Học 11 (Kết nối tri thức) Bài 1: Khái niệm về cân bằng hóa học
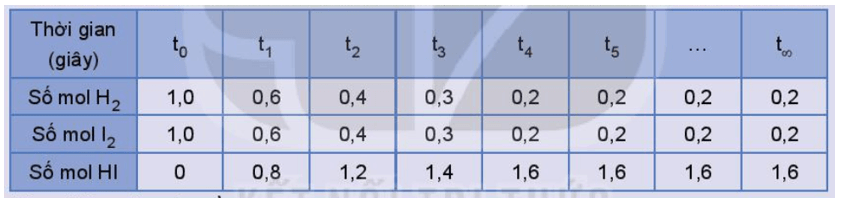
Hoạt động trang 8 Hóa học 11: Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g).
Số liệu về sự thay đổi số mol các chất trong bình phản ứng ở thí nghiệm 1 được trình bày trong Bảng 1.1 dưới đây:
Bảng 1.1. Số mol các chất trong bình phản ứng của thí nghiệm 1 thay đổi theo thời gian
Thực hiện các yêu cầu:
a) Vẽ đồ thị biểu diễn sự thay đổi số mol các chất theo thời gian.
b) Từ đồ thị, nhận xét về sự thay đổi số mol của các chất theo thời gian.
c) Viết biểu thức định luật tác dụng khối lượng đối với phản ứng thuận và phản ứng nghịch, từ đó dự đoán sự thay đổi tốc độ của mỗi phản ứng theo thời gian (biết các phản ứng này đều là phản ứng đơn giản).
d) Bắt đầu từ thời điểm nào thì số mol các chất trong hệ phản ứng không thay đổi nữa?
Giải Hóa Học 11 (Kết nối tri thức) Bài 1: Khái niệm về cân bằng hóa học
Câu hỏi 3 trang 8 Hóa học 11: Nhận xét nào sau đây không đúng?
A. Trong phản ứng một chiều, chất sản phẩm không phản ứng được với nhau tạo thành chất đầu.
B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau để tạo thành chất đầu.
C. Phản ứng một chiều là phản ứng luôn xảy ra không hoàn toàn.
D. Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng điều kiện.
Giải Hóa Học 11 (Kết nối tri thức) Bài 1: Khái niệm về cân bằng hóa học
Hoạt động trang 6 Hóa học 11: Hai thí nghiệm sau đều được thực hiện ở cùng một điều kiện (bình kín dung tích 10 L, nhiệt độ 445 oC):
Thí nghiệm 1: Cho 1 mol H2 và 1 mol I2 vào bình kín. Kết quả thí nghiệm cho thấy dù thời gian phản ứng kéo dài bao lâu thì trong bình vẫn chỉ tạo ra 1,6 mol HI; còn dư 0,2 mol H2 và 0,2 mol I2.
Thí nghiệm 2: Thí nghiệm 2: Cho 2 mol HI vào bình. Kết quả thí nghiệm cũng cho thấy dù thời gian phản ứng kéo dài bao lâu thì trong bình vẫn chỉ tạo ra 0,2 mol H2 và 0,2 mol I2; còn dư 1,6 mol HI.
Thực hiện yêu cầu sau:
a) Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm 1 và thí nghiệm 2.
b) Trong cả hai thí nghiệm trên, dù thời gian phản ứng kéo dài bao lâu thì các chất đầu đều còn lại sau phản ứng. Giải thích.
Giải Hóa Học 11 (Kết nối tri thức) Bài 1: Khái niệm về cân bằng hóa học
Mở đầu trang 6 Hóa học 11: Phản ứng hoá học là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên, có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng được với nhau tạo thành chất đầu. Đối với những phản ứng này, làm thế nào để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng?
Giải Hóa Học 11 (Kết nối tri thức) Bài 1: Khái niệm về cân bằng hóa học
Nhận xét nào dưới đây về đặc điểm chung của các chất hữu cơ không đúng?
Đề thi cuối kì 1 Hóa học 11 Kết nối tri thức ( Đề 3)
Lưu ý bắt buộc để đảm bảo an toàn khi sử dụng dung dịch sulfuric acid đặc là
lượng acid dư thừa sau khi sử dụng phải đổ xuống cống thoát nước.
Đề thi cuối kì 1 Hóa học 11 Kết nối tri thức ( Đề 3)
Cho các nhận xét sau:
(a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản nghịch.
(b) Ở trạng thái cân bằng, các chất không phản ứng với nhau.
(c) Ở trạng thái cân bằng, nồng độ chất sản phẩm luôn lớn hơn nồng độ chất ban đầu.
(d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Các nhận xét đúng là
Đề thi cuối kì 1 Hóa học 11 Kết nối tri thức ( Đề 3)