50 câu Trắc nghiệm Bài 20: Ôn tập Chương 6 (có đáp án 2024) – Hoá 10 Kết nối tri thức
Bộ 50 câu hỏi trắc nghiệm Hoá 10 (có đáp án) Bài 20: Ôn tập Chương 6 đầy đủ các mức độ sách Kết nối tri thức giúp học sinh ôn luyện trắc nghiệm Hoá 10 Bài 20.
Nội dung bài viết
Xem thêm »
Trắc nghiệm Hóa học 10 Bài 20: Ôn tập Chương 6
Phần 1: Trắc nghiệm Ôn tập Chương 6
Câu 1. Khi nồng độ của tất cả các chất đầu đều bằng đơn vị thì
A. hằng số tốc độ k lớn hơn tốc độ phản ứng.
B. hằng số tốc độ k nhỏ hơn tốc độ phản ứng.
C. hằng số tốc độ k bằng tốc độ phản ứng.
D. hằng số tốc độ k gấp đôi tốc độ phản ứng.
Đáp án: C
Giải thích:
Hằng số tốc độ k là tốc độ phản ứng khi nồng độ của tất cả các chất đầu đều bằng đơn vị.
Câu 2. Hydrogen peroxide phân hủy theo phản ứng: 2H2O2 →2H2O + O2. Sau 15 phút phản ứng, thể tích oxygen thu được là 16 cm3. Tính tốc độ trung bình của phản ứng trong khoảng thời gian trên.
A. 2,108 cm3/phút.
B. 1,067 cm3/phút.
C. 1,368 cm3/phút.
D. 1,896 cm3/phút.
Đáp án: B
Giải thích:
Tốc độ trung bình của phản ứng:
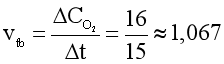 (cm3/phút).
(cm3/phút).
Câu 3. Phát biểu nào sau đây không đúng?
A. Đa số các phản ứng hóa học có tốc độ giảm dần theo thời gian.
B. Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng.
C. Sau phản ứng, kích thước, hình dạng, độ xốp, … của chất xúc tác không đổi.
D. Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia.
Đáp án: C
Giải thích:
Sau phản ứng, khối lượng, bản chất hóa học của chất xúc tác không đổi, tuy nhiên, kích thước, hình dạng, độ xốp, … có thể thay đổi.
Câu 4. Phản ứng giữa H2 và N2 là phản ứng đơn giản: N2(g) + 3H2(g) → 2NH3(g). Viết biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng.
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Đáp án: D
Giải thích:
Phản ứng giữa H2 và N2:
N2(g) + 3H2(g) ® 2NH3(g).
Biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng: ![]() .
.
Câu 5. Xét phản ứng: 2NO + O2 → 2NO. Khi nồng độ NO tăng lên 2 lần thì tốc độ phản ứng
A. tăng lên 2 lần.
B. tăng lên 4 lần.
C. giảm đi 2 lần.
D. giảm đi 4 lần.
Đáp án: B
Giải thích:
Xét phản ứng: 2NO + O2 ® 2NO.
Biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng: ![]() .
.
Khi nồng độ NO tăng lên 2 lần thì tốc độ phản ứng là:
![]() .
.
® Tốc độ phản ứng tăng lên 4 lần.
Câu 6. Thực hiện hai phản ứng phân hủy H2O2:
Thí nghiệm 1: Có xúc tác MnO2.
Thí nghiệm 2: Không dùng xúc tác.
So sánh tốc độ thoát khí ở hai thí nghiệm.
A. Thí nghiệm 1 có tốc độ thoát khí oxygen nhanh hơn.
B. Thí nghiệm 2 có tốc độ thoát khí oxygen nhanh hơn.
C. Cả 2 thí nghiệm có tốc độ thoát khí như nhau.
D. Không so sánh được.
Đáp án: A
Giải thích:
Chất xúc tác làm tăng tốc độ phản ứng nhưng nó không bị biến đổi về lượng và chất sau phản ứng.
® Thí nghiệm 1 có tốc độ thoát khí oxygen nhanh hơn.
Câu 7. Nung đá vôi ở nhiệt độ cao hơn để sản xuất vôi sống. Người ta đã lợi dụng yếu tố nào để tăng tốc độ phản ứng trên?
A. Nồng độ.
B. Áp suất.
C. Nhiệt độ.
D. Chất xúc tác.
Đáp án: C
Giải thích:
Nung đá vôi ở nhiệt độ cao hơn để sản xuất vôi sống.
Người ta đã lợi dụng yếu tố nhiệt độ để tăng tốc độ phản ứng trên.
Chú ý: Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
Câu 8. Cho phản ứng đơn giản: aA + bB →cC + dD. Biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng là:
A.![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Đáp án: C
Giải thích:
Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ thuận với tích số nồng độ các chất phản ứng với số mũ thích hợp. Đối với phản ứng đơn giản (phản ứng chỉ xảy ra qua một giai đoạn), số mũ là hệ số của chất tham gia trong phương trình hóa học.
® ![]() .
.
Câu 9. Cho khoảng 2 gam zinc (kẽm) dạng hạt vào một cốc đựng dung dịch H2SO4 2M (dư) ở nhiệt độ phòng. Nếu thay dung dịch H2SO4 2M bằng dung dịch H2SO4 1M có cùng thể tích (các điều kiện khác giữ nguyên) thì
A. tốc độ phản ứng không đổi.
B. tốc độ phản ứng tăng lên.
C. tốc độ phản ứng giảm đi.
D. tốc độ phản ứng tăng lên 2 lần.
Đáp án: C
Giải thích:
Khi nồng độ chất phản ứng giảm đi, số va chạm giữa các hạt giảm đi, làm số va chạm hiệu quả cũng giảm đi và dẫn đến tốc độ phản ứng giảm.
® Nếu thay dung dịch H2SO4 2M bằng dung dịch H2SO4 1M có cùng thể tích (các điều kiện khác giữ nguyên) thì tốc độ phản ứng giảm đi.
Câu 10. Cho các phản ứng sau:
(a) Than cháy.
(b) Sắt bị gỉ.
(c) Tinh bột lên men rượu.
Trong các phản ứng trên, phản ứng nào xảy ra chậm?
A. (a).
B. (a) và (b).
C. (a) và (c).
D. (b) và (c).
Đáp án: D
Giải thích:
Phản ứng xảy ra nhanh: (a) Than cháy.
Phản ứng xảy ra chậm: (b) Sắt bị gỉ; (c) Tinh bột lên men rượu.
Câu 11. Tốc độ phản ứng đặc trưng cho
A. sự nhanh chậm của một phản ứng hóa học.
B. thời gian để phản ứng xảy ra hoàn toàn.
C. mức độ phản ứng của các chất tham gia.
D. sự thay đổi khối lượng của các chất tham gia.
Đáp án: A
Giải thích:
Tốc độ phản ứng đặc trưng cho sự nhanh chậm của một phản ứng hóa học.
Câu 12. Khi tăng nhiệt độ thì
A. tốc độ phản ứng tăng.
B. tốc độ phản ứng giảm.
C. tốc độ phản ứng tăng lên gấp đôi.
D. tốc độ phản ứng giảm đi một nửa.
Đáp án: A
Giải thích:
Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
Câu 13. Ở nhiệt độ không đổi, tốc độ phản ứng
A. tỉ lệ nghịch với tích số nồng độ các chất phản ứng với số mũ thích hợp.
B. tỉ lệ thuận với tích số nồng độ các chất phản ứng với số mũ thích hợp.
C. tỉ lệ thuận với tổng nồng độ các chất phản ứng với số mũ thích hợp.
D. tỉ lệ nghịch với tổng nồng độ các chất phản ứng với số mũ thích hợp.
Đáp án: B
Giải thích:
Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ thuận với tích số nồng độ các chất phản ứng với số mũ thích hợp. Đối với phản ứng đơn giản (phản ứng chỉ xảy ra qua một giai đoạn), số mũ là hệ số của chất tham gia trong phương trình hóa học.
Câu 14. Khi tăng diện tích bề mặt tiếp xúc thì
A. tốc độ phản ứng tăng.
B. tốc độ phản ứng giảm.
C. tốc độ phản ứng không thay đổi.
D. tốc độ phản ứng tăng lên gấp đôi.
Đáp án: A
Giải thích:
Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số va chạm hiệu quả cũng tăng theo, dẫn đến tốc độ phản ứng tăng.
Câu 15. Ở 20oC, tốc độ một phản ứng là 0,05 mol/(L.min). Ở 30oC, tốc độ phản ứng này là 0,15 mol/(L.min). Dự đoán tốc độ phản ứng trên ở 40oC (giả thiết hệ số nhiệt g trong khoảng này không thay đổi).
A. 0,45 mol/(L.min).
B. 0,35 mol/(L.min).
C. 0,25 mol/(L.min).
D. 0,15 mol/(L.min).
Đáp án: A
Giải thích:
Ta có: 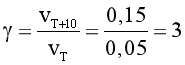 .
.
® 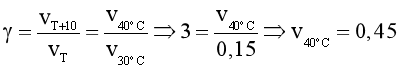 (mol/(L.min)).
(mol/(L.min)).
Phần 2: Lý thuyết Ôn tập Chương 6
I. Tốc độ phản ứng
Xét phản ứng hóa học dạng tổng quát: aA + bB cC + dD
Biểu thức tốc độ trung bình của phản ứng:
Trong đó: DCA, DCB, DCC, DCD lần lượt là biến thiên lượng chất các chất A, B, C, D trong khoảng thời gian Dt.
Nếu phản ứng trên là một phản ứng đơn giản thì biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng: .
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng
1. Nồng độ
Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng.
2. Áp suất
Đối với phản ứng có sự tham gia của chất khí, khi áp suất tăng, tốc độ phản ứng tăng.
3. Nhiệt độ
Khi nhiệt độ phản ứng tăng dẫn đến số va chạm hiệu quả giữa các chất phản ứng tăng, làm tốc độ phản ứng tăng.
4. Diện tích bề mặt tiếp xúc
Để tăng tốc độ phản ứng, ta có thể tăng diện tích bề mặt tiếp xúc của chất phản ứng bằng cách làm giảm kích thước hạt rắn hoặc tạo những hạt xốp.
5. Chất xúc tác
Chất xúc tác làm tăng tốc độ phản ứng nhưng nó không bị biến đổi về lượng và chất sau phản ứng.
Ví dụ: Cho khoảng 2 g zinc (kẽm) dạng hạt vào một cốc đựng dung dịch H2SO4 2M (dư) ở nhiệt độ phòng. Nếu chỉ biến đổi một trong các điều kiện sau đây (các điều kiện khác giữ nguyên) thì tốc độ phản ứng sẽ thay đổi thế nào (tăng lên, giảm xuống hay không đổi)?
(a) Thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều.
(b) Thay dung dịch H2SO4 2M bằng dung dịch H2SO4 1M có cùng thể tích.
(c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50oC).
Hướng dẫn giải:
(a) Thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều.
Làm tăng diện tích bề mặt tiếp xúc của chất phản ứng, do đó làm tăng tốc độ phản ứng.
(b) Thay dung dịch H2SO4 2M bằng dung dịch H2SO4 1M có cùng thể tích.
Nồng độ H2SO4 giảm, do đó làm giảm tốc độ phản ứng.
(c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50oC).
Khi nhiệt độ phản ứng tăng dẫn đến số va chạm hiệu quả giữa các chất phản ứng tăng, làm tốc độ phản ứng tăng.