Lý thuyết Cấu tạo bảng tuần hoàn các nguyên tố hóa học (Chân trời sáng tạo 2024) Hóa 10
Tóm tắt lý thuyết Hóa 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học ngắn gọn, chính xác sách Chân trời sáng tạo sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa 10.
Lý thuyết Hóa học lớp 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
A. Lý thuyết Cấu tạo bảng tuần hoàn các nguyên tố hóa học
I. Lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học
- Năm 1869, nhà hóa học Mendeleev đã công bố bảng tuần hoàn các nguyên tố hóa học, trong đó, các nguyên tố được sắp xếp theo thứ tự tăng dần khối lượng nguyên tử.

- Bảng tuần hoàn hiện đại ngày nay được xây dựng trên cơ sở mối liên hệ giữa số hiệu nguyên tử và tính chất của nguyên tố, các nguyên tố được sắp xếp theo thứ tự tăng dần số hiệu nguyên tử.
II. Bảng tuần hoàn các nguyên tố hóa học
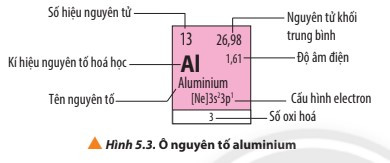
1. Ô nguyên tố
- Mỗi nguyên tố hóa học được xếp vào một ô trong bảng tuần hoàn các nguyên tố hóa học, gọi là ô nguyên tố.
- Số thứ tự của một ô nguyên tố bằng số hiệu nguyên tử của nguyên tố hóa học trong ô đó.
- Ví dụ: Ô nguyên tố aluminium
2. Chu kì
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là chu kì.
- Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì.
- Bảng tuần hoàn gồm 7 chu kì:
+ Các chu kì 1, 2 và 3 là các chu kì nhỏ.
+ Các chu kì 4, 5, 6 và 7 là các chu kì lớn.

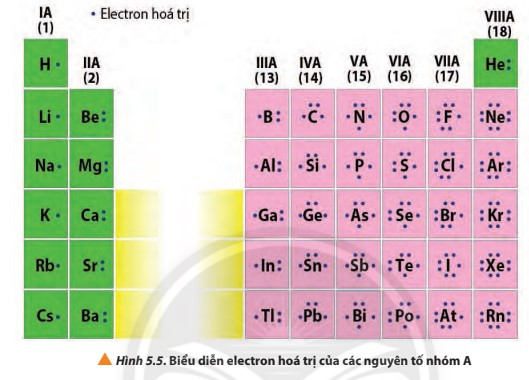
3. Nhóm
- Nhóm là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau (trừ nhóm VIIIB), do đó có tính chất hóa học gần giống nhau và được xếp theo cột.
- Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong nhóm.
- Bảng tuần hoàn hiện nay có 18 cột, chia thành 8 nhóm A (IA đến VIIIA) và 8 nhóm B (IB đến VIIIB). Mỗi cột tương ứng với một nhóm, riêng nhóm VIIIB có 3 cột.
- Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học. Chúng thường nằm ở lớp ngoài cùng hoặc cả ở phân lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hòa. Những nguyên tố có cùng số electron hóa trị thường có tính chất hóa học tương tự nhau.
4. Phân loại nguyên tố dựa theo cấu hình electron và tính chất hóa học
- Các nguyên tố hóa học cũng có thể được chia thành các khối như sau:
+ Khối các nguyên tố s gồm các nguyên tố thuộc nhóm IA và nhóm IIA, có cấu hình electron: [Khí hiếm] ns1-2.
+ Khối các nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến VIIIA (trừ nguyên tố He), có cấu hình electron: [Khí hiếm] ns2np1-6.
+ Khối các nguyên tố d gồm các nguyên tố nhóm B, có cấu hình electron: [khí hiếm] (n – 1)d1-10ns1-2.
+ Khối các nguyên tố f gồm các nguyên tố xếp thành 2 hàng ở cuối bảng tuần hoàn, có cấu hình electron: [Khí hiếm] (n – 2)f0-14(n – 1)d0-2ns2 (trong đó n = 6 và n = 7)
- Dựa vào tính chất hóa học, người ta phân loại các nguyên tố hóa học thành:
+ Nguyên tố kim loại;
+ Nguyên tố phi kim;
+ Khí hiếm.
5. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
+ Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một chu kì.
+ Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp vào cùng một nhóm, trừ nhóm VIIIB.
B. Trắc nghiệm Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Câu 1. Theo bảng tuần hoàn của Mendeleev, các nguyên tố được sắp xếp theo thứ tự tăng dần
A. khối lượng nguyên tử
B. cấu hình electron
C. số hiệu nguyên tử
D. số khối
Đáp án đúng là: A
Theo bảng tuần hoàn của Mendeleev, các nguyên tố được sắp xếp theo thứ tự tăng dần khối lượng nguyên tử.
Câu 2. Bảng tuần hoàn các nguyên tố hóa học hiện đại ngày nay được xây dựng dựa trên cơ sở mối liên hệ giữa
A. khối lượng nguyên tử và tính chất;
B. số hiệu nguyên tử và tính chất;
C. số khối và tính chất;
D. cấu hình electron và tính chất.
Đáp án đúng là: B
Bảng tuần hoàn các nguyên tố hóa học hiện đại ngày nay được xây dựng dựa trên cơ sở mối liên hệ giữa số hiệu nguyên tử và tính chất của các nguyên tố, các nguyên tố được sắp xếp theo thứ tự tăng dần của số hiệu nguyên tử.
Câu 3. Bảng tuần hoàn gồm có
A. 7 chu kì: 4 chu kì nhỏ và 3 chu kì lớn
B. 8 chu kì: 4 chu kì nhỏ và 4 chu kì lớn
C. 18 chu kì: 8 chu kì nhỏ và 10 chu kì lớn
D. 7 chu kì: 3 chu kì nhỏ và 4 chu kì lớn
Đáp án đúng là: D
Bảng tuần hoàn gồm có 7 chu kì:
3 chu kì nhỏ là các chu kì 1; 2 và 3.
4 chu kì lớn là các chu kì 4; 5; 6 và 7.
Câu 4. Nguyên tố có số hiệu nguyên tử là 19 thuộc chu kì nào trong bảng tuần hoàn?
A. 2
B. 3
C. 4
D. 7
Đáp án đúng là: C
Nguyên tố có số hiệu nguyên tử là 19 ⇒ Cấu hình electron: 1s22s22p63s23p64s1
⇒ Có 4 lớp electron.
Mà số thứ tự chu kì = số lớp electron
Do đó, thứ tự chu kì = số lớp electron = 4
Vậy nguyên tố có số hiệu nguyên tử là 19 thuộc chu kì 4 trong bảng tuần hoàn.
Câu 5. Các electron có khả năng tham gia hình thành liên kết hóa học là
A. electron s
B. electron p
C. electron hóa trị
D. electron ở lớp trong cùng
Đáp án đúng là: C
Các electron có khả năng tham gia hình thành liên kết hóa học là electron hóa trị.
Chúng thường nằm ở lớp ngoài cùng hoặc cả phân lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hòa.
Câu 6. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn là
A. Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp cùng một chu kì
C. Các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau được xếp cùng một nhóm
D. Cả A, B và C đều đúng.
Đáp án đúng là: D
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn là:
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp cùng một chu kì
- Các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau được xếp cùng một nhóm.
Câu 7. Nguyên tố aluminium (Al) có số hiệu nguyên tử là 13. Al thuộc khối nguyên tố
A. s
B. p
C. d
D. f
Đáp án đúng là: B
Cấu hình electron nguyên tử của Al là: 1s22s22p63s23p1 ⇒ cấu hình electron lớp ngoài cùng là 3s23p1.
Nên Al thuộc khối nguyên tố p.
Câu 8. Năm 1869, nhà hóa học đã công bố bảng tuần hoàn các nguyên tố hóa học là
A. Rutherford
B. Niu-tơn
C. Tôm-xơn
D. Mendeleev
Đáp án đúng là: D
Năm 1869, nhà hóa học đã công bố bảng tuần hoàn các nguyên tố hóa học là Mendeleev.
Câu 9. Số thứ tự của một ô nguyên tố bằng
A. số lớp electron của nguyên tố hóa học trong ô đó
B. số electron lớp ngoài cùng của nguyên tố hóa học trong ô đó
C. số hiệu nguyên tử của nguyên tố hóa học trong ô đó
D. số khối của nguyên tố hóa học trong ô đó
Đáp án đúng là: C
Số thứ tự của một ô nguyên tố bằng số hiệu nguyên tử của nguyên tố hóa học trong ô đó.
Câu 10. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là
A. chu kì
B. ô nguyên tố
C. nhóm
D. bảng tuần hoàn
Đáp án đúng là: A
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là chu kì.
Câu 11. Nguyên tố Y (Z = 17). Trong bảng tuần hoàn, Y thuộc nhóm
A. IIIA
B. VIIA
C. IIIB
D. VA
Đáp án đúng là: B
Nguyên tố Y (Z = 17) ⇒ Cấu hình electron: 1s22s22p63s23p5
⇒ cấu hình electron lớp ngoài cùng là 3s23p5.
Nên Y thuộc khối nguyên tố p ⇒ Y thuộc nhóm A.
Số thứ tự nhóm A = số electron lớp ngoài cùng = 2 + 5 = 7
Vậy Y thuộc nhóm VIIA.
Câu 12. Nguyên tố Y ở chu kì 3 nhóm IVA. Cấu hình electron nguyên tử của Y là
A. 1s22s22p63s23p4
B. 1s22s22p63s23p2
C. 1s22s22p63s23p6
D. 1s22s22p63s23p63d34s2
Đáp án đúng là: B
Nguyên tố Y ở chu kì 3 ⇒ Y có 3 lớp electron
Nhóm IVA nên cấu hình electron lớp ngoài cùng có dạng ns2np1:6 và có 4 electron lớp ngoài cùng ⇒ cấu hình electron lớp ngoài cùng có dạng ns2np2
Cấu hình electron nguyên tử của Y là: 1s22s22p63s23p2
Câu 13. Cho nguyên tố X có số hiệu nguyên tử là 23. Vị trí của X trong bảng tuần hoàn là
A. ô số 23, chu kì 4, nhóm IIIA;
B. ô số 23, chu kì 4, nhóm IIIB;
C. ô số 23, chu kì 3, nhóm IIIA;
D. ô số 23, chu kì 4, nhóm VB.
Đáp án đúng là: D
ZX = 23 ⇒ Cấu hình electron nguyên tử của X: 1s22s22p63s23p63d34s2
ZX = 23 ⇒ X ở ô số 23
X có 4 lớp electron ⇒ X ở chu kì 4
Phân lớp 3d có mức năng lượng cao nhất ⇒ X là nguyên tố d ⇒ X thuộc nhóm B
Số thứ tự nhóm B = số electron hóa trị
= số electron lớp ngoài cùng + số electron ở phân lớp sát lớp ngoài cùng chưa bão hòa
= 2 + 3 = 5
Vậy X ở ô số 23, chu kì 4, nhóm VB.
Câu 14. Argon (Ar) có số hiệu nguyên tử là 18. Ar là nguyên tố
A. kim loại
B. phi kim
C. khí hiếm
D. kim loại hoặc phi kim
Đáp án đúng là: C
Argon (Ar) có số hiệu nguyên tử là 18 ⇒ Cấu hình electron nguyên tử của Ar: 1s22s22p63s23p6
⇒ có 8 electron lớp ngoài cùng ⇒ Ar là nguyên tố khí hiếm.
Câu 15. Cấu hình electron của nguyên tố khí hiếm thuộc chu kì 2 là
A. 1s22s2
B. 1s22s22p4
C. 1s22s22p6
D. 1s2
Đáp án đúng là: C
Nguyên tố thuộc chu kì 2 ⇒ có 2 lớp electron.
Nguyên tố kí hiếm từ chu kì 2 trở đi có 8 electron lớp ngoài cùng.
⇒ Cấu hình electron lớp ngoài cùng là: 2s22p6
⇒ Cấu hình electron: 1s22s22p6.
Bài giảng Hóa học 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học - Chân trời sáng tạo