Lý thuyết pH của dung dịch. Chuẩn độ acid – base (Cánh diều 2024) Hóa 11
Tóm tắt lý thuyết Hóa 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base ngắn gọn, chính xác sách Cánh diều sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa 11.
Lý thuyết Hóa 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base - Cánh diều
A. Lý thuyết pH của dung dịch. Chuẩn độ acid – base
I. pH của dung dịch, chất chỉ thị
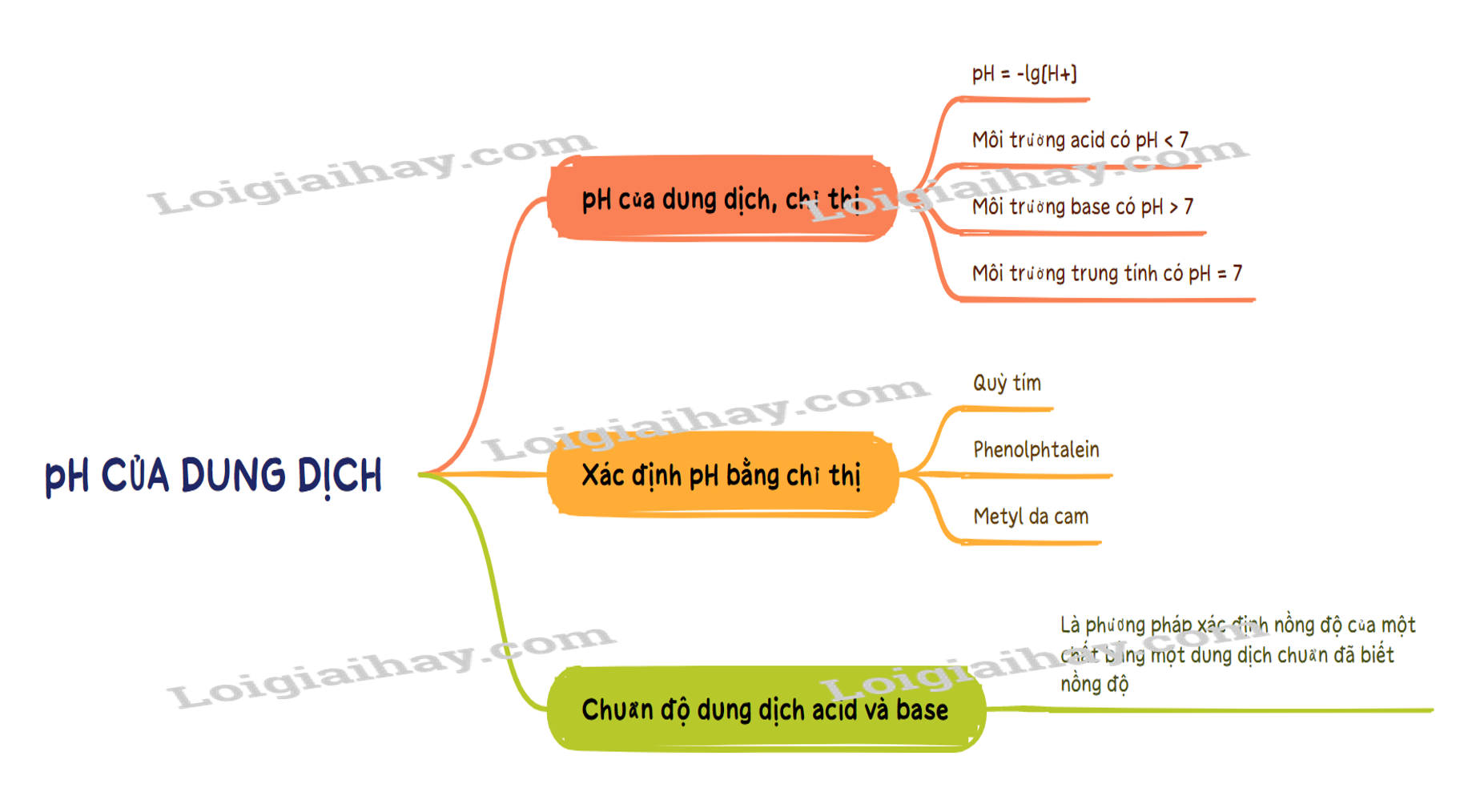
1. pH của dung dịch
|
pH = -lg[H+] hoặc [H+] = 10-pH |
với [H+] là nồng độ mol của ion H+.
- Môi trường acid có pH < 7.
- Môi trường base có pH > 7.
- Môi trường trung tính có pH = 7.
2. Ý nghĩa của pH trong thực tiễn
- pH có ý nghĩa trong tự nhiên, trong sản xuất và trong cơ thể sống xảy ra trong dung dịch nước với sự có mặt của các acid – base.
3. Xác định pH bằng chất chỉ thị
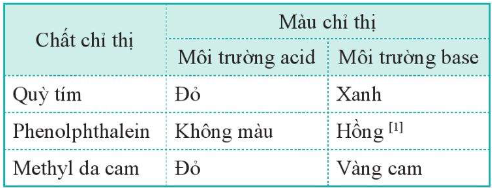
II. Chuẩn độ dung dịch acid và base
Nguyên tắc: Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.
Sơ đồ tư duy pH của dung dịch. Chuẩn độ acid – base
B. Bài tập pH của dung dịch. Chuẩn độ acid – base
Đang cập nhật ...