Lý thuyết Thành phần của nguyên tử (Kết nối tri thức 2024) Hóa 10
Tóm tắt lý thuyết Hóa 10 Bài 1: Thành phần của nguyên tử ngắn gọn, chính xác sách Kết nối tri thức sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa 10.
Lý thuyết Hóa học lớp 10 Bài 1: Thành phần của nguyên tử
Video giải Hóa học 10 Bài 1: Thành phần của nguyên tử - Kết nối tri thức
A. Lý thuyết Thành phần của nguyên tử
I. Các loại hạt cấu tạo nên nguyên tử
Năm 1897, J. J. Thomson thực hiện thí nghiệm phóng điện qua không khí loãng đã phát hiện ra chùm tia phát ra từ cực âm và bị hút lệch về phía cực dương của điện trường, chứng tỏ chúng mang điện tích âm. Đó chính là chùm các hạt electron. Electron là một thành phần của nguyên tử.
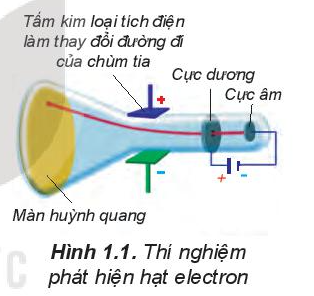
Năm 1911, E.Rutherford thực hiện thí nghiệm bắn phá lá vàng rất mỏng bằng chùm hạt a (alpha).
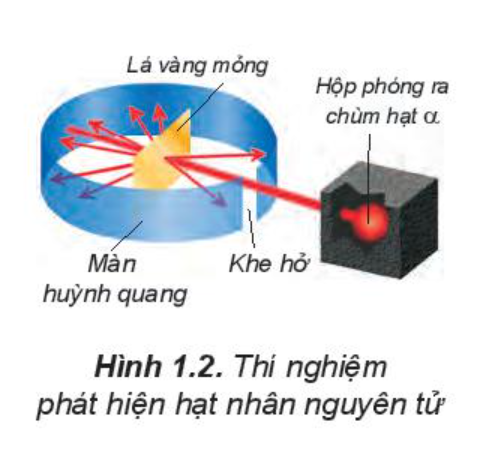
Kết quả thí nghiệm: hầu hết các hạt a đều xuyên thẳng qua lá vàng, chứng tỏ nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương và có kích thước rất nhỏ so với kích thước nguyên tử.
Năm 1918, E.Rutherford và các cộng sự khi dùng hạt a bắn phá nitrogen đã phát hiện ra hạt proton.
Năm 1932, J. Chadwick, cộng sự của Rutherford, đã phát hiện ra hạt neutron khi bắn phá berylium bằng các hạt a.
Kết luận:
Thành phần cấu tạo của nguyên tử gồm:
- Hạt nhân: ở tâm của nguyên tử, chứa các proton mang điện tích dương và các neutron không mang điện (trừ trường hợp H11).
- Vỏ nguyên tử: chứa các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân.
Khối lượng, điện tích của các loại hạt cấu tạo nên nguyên tử:
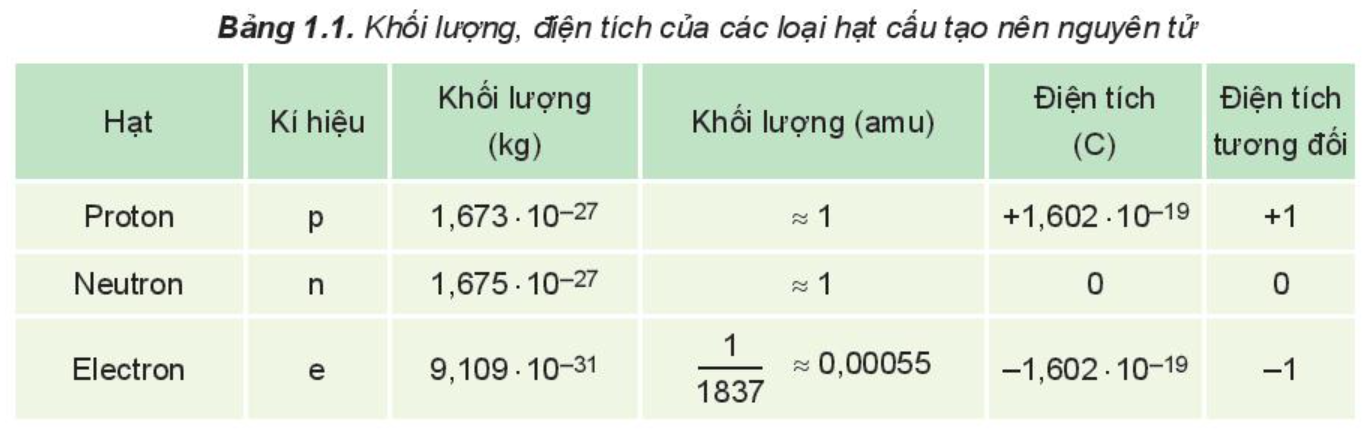
Trong nguyên tử, số proton bằng số electron. Nguyên tử trung hòa về điện.
Khối lượng của electron rất nhỏ, không đáng kể so với khối lượng của proton hay neutron nên khối lượng của nguyên tử tập trung hầu hết ở hạt nhân.
II. Kích thước và khối lượng của nguyên tử
1. Kích thước
Kích thước của nguyên tử rất nhỏ nên thường được biểu diễn bằng đơn vị picomet (pm) hay Angstrom (Å).
1 pm = 10-12 m; 1oA = 10-10 m
Hạt nhân nguyên tử có kích thước vô cùng nhỏ so với nguyên tử.
2. Khối lượng
Khối lượng nguyên tử bằng tổng khối lượng các hạt proton, neutron và electron có trong nguyên tử.
Có thể biểu thị khối lượng nguyên tử theo đơn vị khối lượng nguyên tử, kí hiệu amu.
1 amu = 1,661×10-27 kg
Ví dụ: Một nguyên tử oxygen có khối lượng là 2,656×10-26 kg.
1 amu = 1,661×10-27 kg nên khối lượng của một nguyên tử oxygen là: 2,656×10−261,661×10−27=15,990(amu).
III. Điện tích hạt nhân và số khối
- Số proton trong hạt nhân nguyên tử bằng số đơn vị điện tích hạt nhân, kí hiệu là Z.
Ví dụ: Hạt nhân nguyên tử Na có 11 proton nên số đơn vị điện tích hạt nhân là Z = 11.
- Tổng số proton và tổng số neutron (kí hiệu là N) trong hạt nhân của một nguyên tử được gọi là số khối (hay số nucleon), kí hiệu là A.
A = Z + N
Ví dụ: Hạt nhân nguyên tử Na có 11 proton và 12 neutron.
Số khối của hạt nhân nguyên tử Na là: A = 11 + 12 = 23.
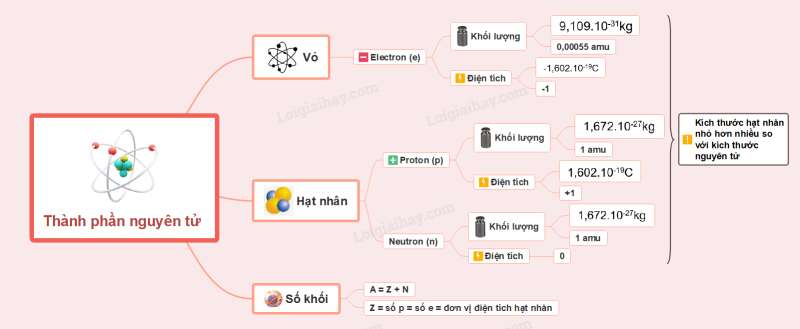
Sơ đồ tư duy lý thuyết Thành phần của nguyên tử
B. Trắc nghiệm Thành phần của nguyên tử
Câu 1. Khối lượng của nguyên tử tập trung hầu hết ở
A. vỏ nguyên tử.
B. hạt nhân nguyên tử.
C. phần không gian trống trong nguyên tử.
D. một phần hạt nhân nguyên tử.
Đáp án: B
Giải thích:
Khối lượng của electron rất nhỏ, không đáng kể so với khối lượng của proton hay neutron nên khối lượng của nguyên tử tập trung hầu hết ở hạt nhân.
Câu 2: Số đơn vị điện tích hạt nhân (Z) bằng
A. số proton.
B. số neutron.
C. tổng số proton và electron.
D. tổng số proton và neutron.
Đáp án: A
Giải thích:
Số proton trong hạt nhân nguyên tử bằng số đơn vị điện tích hạt nhân, kí hiệu là Z.
Câu 3: Hạt nhân nguyên tử chlorine (Cl) có 17 proton. Số đơn vị điện tích hạt nhân của nugyên tử chlorine là
A. 17.
B. 16.
C. 15.
D. 14.
Đáp án: A
Giải thích:
Số proton trong hạt nhân nguyên tử bằng số đơn vị điện tích hạt nhân, kí hiệu là Z.
Hạt nhân nguyên tử Cl có 17 proton nên số đơn vị điện tích hạt nhân là Z = 17.
Câu 4. Phát biểu nào sau đây không đúng?
A. Kích thước của nguyên tử là khoảng không gian tạo bởi sự chuyển động của các electron.
B. Các nguyên tử khác nhau có số electron khác nhau nên có kích thước khác nhau.
C. Kích thước nguyên tử rất nhỏ nên thường được biểu diễn bằng đơn vị picomet (pm) hay Ăngstrom (˙Α).
D. Hạt nhân nguyên tử có kích thước gần bằng kích thước nguyên tử.
Đáp án: D
Giải thích:
Hạt nhân nguyên tử có đường kính khoảng 10-2 pm, kích thước nhỏ hơn nhiều so với kích thước nguyên tử.
Câu 5. Có thể biểu thị khối lượng nguyên tử theo đơn vị khối lượng nguyên tử, kí hiệu amu. Trong đó:
A. 1 amu = 1,661.10-27 kg.
B. 1 amu = 1,661.10-27 g.
C. 1 amu = 1,661.10-24 kg.
D. 1 amu = 1,661.10-24 mg.
Đáp án: A
Giải thích:
Có thể biểu thị khối lượng nguyên tử theo đơn vị khối lượng nguyên tử, kí hiệu amu.
1 amu = 1,661.10-27 kg.
Câu 6. 1 amu được định nghĩa bằng
A. 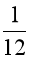 khối lượng 1 nguyên tử nitrogen – 14.
khối lượng 1 nguyên tử nitrogen – 14.
B. 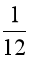 khối lượng 1 nguyên tử carbon – 12.
khối lượng 1 nguyên tử carbon – 12.
C. 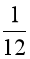 khối lượng 1 nguyên tử carbon – 12.
khối lượng 1 nguyên tử carbon – 12.
D. 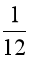 khối lượng 1 nguyên tử nitrogen – 14.
khối lượng 1 nguyên tử nitrogen – 14.
Đáp án: A
Giải thích:
1 amu được định nghĩa bằng 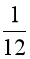 khối lượng 1 nguyên tử carbon – 12.
khối lượng 1 nguyên tử carbon – 12.
1 amu = 1,661.10-27 kg.
Câu 7. Khối lượng của một nguyên tử oxygen là 15,990 amu. Biết 1 amu = 1,661.10-27 kg. Một nguyên tử oxygen có khối lượng là
A. 2,656.10-24 kg.
B. 3,126.10-26 kg.
C. 2,656.10-26 kg.
D. 3,126.10-24 kg.
Đáp án: C
Giải thích:
Một nguyên tử oxygen có khối lượng là:
![]() (kg).
(kg).
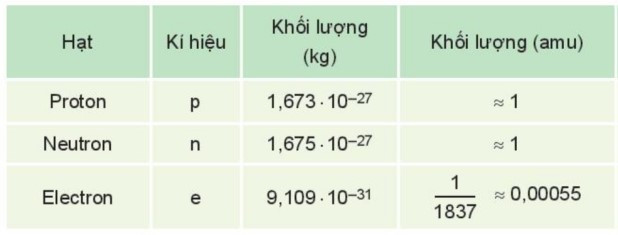
Câu 8. Cho biết khối lượng của các hạt proton, neutron và electron:
Một loại nguyên tử nitrogen có 7 proton và 7 neutron trong hạt nhân. Khối lượng của nguyên tử nitrogen là
A. 13,000 amu.
B. 13,025 amu.
C. 14,385 amu.
D. 14,00385 amu.
Đáp án: A
Giải thích:
Trong nguyên tử, số proton = số electron = 7.
Khối lượng nguyên tử nitrogen là:
mp + mn + me = 1×7 + 0,00055×7 + 1×7 = 14,00385 (amu).
Câu 9. Nguyên tử chứa những hạt mang điện là
A. proton và neutron.
B. proton và electron.
C. proton, neutron và electron.
D. electron và neutron.
Đáp án: B
Giải thích:
Nguyên tử gồm hạt nhân (chứa proton mang điện tích dương và neutron không mang điện) và vỏ nguyên tử (chứa electron mang điện tích âm).
Câu 10. Vỏ nguyên tử chứa
A. các electron mang điện tích dương, chuyển động rất nhanh xung quanh hạt nhân.
B. các electron không mang điện tích, chuyển động rất nhanh xung quanh hạt nhân.
C. các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân.
D. các proton và neutron, chuyển động rất nhanh xung quanh hạt nhân.
Đáp án: C
Giải thích:
Vỏ nguyên tử chứa các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân.
Câu 11. Nguyên tử trung hòa về điện, vì
A. số proton bằng số electron.
B. số proton bằng số neutron.
C. số electron bằng số neutron.
D. tất cả các hạt trong nguyên tử đều không mang điện.
Đáp án: A
Giải thích:
Nguyên tử gồm hạt nhân (chứa proton mang điện tích dương và neutron không mang điện) và vỏ nguyên tử (chứa electron mang điện tích âm).
Trong nguyên tử, số proton bằng số electron. Nguyên tử trung hòa về điện.
Câu 12. Nguyên tử sodium có 11 proton. Số electron trong nguyên tử sodium là
A. 12.
B. 11.
C. 10.
D. 9.
Đáp án: B
Giải thích:
Trong nguyên tử sodium, số proton = số electron = 11.
Câu 13: Số khối (A) bằng
A. tổng số proton và tổng số electron trong hạt nhân của một nguyên tử.
B. tổng số proton và tổng số neutron trong hạt nhân của một nguyên tử.
C. tổng số neutron và tổng số electron trong hạt nhân của một nguyên tử.
D. tổng số proton, neutron và electron trong hạt nhân của một nguyên tử.
Đáp án: B
Giải thích:
Tổng số proton và tổng số neutron (kí hiệu là N) trong hạt nhân của một nguyên tử được gọi là số khối (hay số nucleon), kí hiệu là A.
A = Z + N
Câu 14: Hạt nhân nguyên tử K có số proton là 19 và số neutron là 20. Số khối của hạt nhân nguyên tử K là
A. 19.
B. 20.
C. 38.
D. 39.
Đáp án: D
Giải thích:
Tổng số proton và tổng số neutron (kí hiệu là N) trong hạt nhân của một nguyên tử được gọi là số khối (hay số nucleon), kí hiệu là A.
A = Z + N = 19 + 20 = 39
Câu 15: Aluminium (nhôm) là kim loại phổ biến nhất trên vỏ Trái Đất, được sử dụng trong các ngành xây dựng, ngành điện hoặc sản xuất đồ gia dụng. Hạt nhân của nguyên tử aluminium có điện tích bằng +13 và số khối bằng 27. Số proton, neutron và electron trong nguyên tử aluminium lần lượt là:
A. 13, 13, 14.
B. 13, 14, 13.
C. 14, 14, 13.
D. 14, 13, 14.
Đáp án: B
Giải thích:
Số proton = Số đơn vị điện tích hạt nhân (Z) = 13.
® Số electron = Số proton = 13.
A = Z + N ® N = A – Z = 27 – 13 = 14.
Vậy, số proton, neutron và electron trong nguyên tử aluminium lần lượt là: 13, 14, 13.
Bài giảng Hóa học 10 Bài 1: Thành phần của nguyên tử - Kết nối tri thức