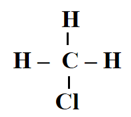50 câu Trắc nghiệm Bài 14: Tính biến thiên enthalpy của phản ứng hóa học (có đáp án 2024) – Hoá 10 Chân trời sáng tạo
Bộ 50 câu hỏi trắc nghiệm Hoá 10 (có đáp án) Bài 14: Tính biến thiên enthalpy của phản ứng hóa học đầy đủ các mức độ sách Chân trời sáng tạo giúp học sinh ôn luyện trắc nghiệm Hoá 10 Bài 14.
Nội dung bài viết
Trắc nghiệm Hóa học 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Phần 1: Trắc nghiệm Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Câu 1. Cho phản ứng:
3O2 (g)⟶2O3 (g)(1)
2O3 (g) ⟶ 3O2 (g)(2)
Biết phân tử O3 gồm 1 liên kết đôi O = O và 1 liên kết đơn O – O.
So sánh ∆ của hai phản ứng là
A. (1) > (2);
B. (1) = (2);
C. (1) < (2);
D. (1) ≤ (2).
Đáp án đúng là: A
Biến thiên enthalpy chuẩn của phản ứng (1) là:
(1) =
=
= 90 (kJ)
Biến thiên enthalpy chuẩn của phản ứng (2) là:
(2) =
=
= − 90 (kJ)
Do đó: (1) > (2)
Câu 2. Tính lượng nhiệt sinh ra khi đốt cháy hoàn toàn 7,8 gam C6H6 (l)
Cho enthalpy tạo thành chuẩn của các chất tương ứng là
|
Chất |
C6H6 (l) |
CO2 (g) |
H2O (g) |
|
(kJ/mol) |
+49 |
− 393,5 |
-241,82 |
A. 3135,46 kJ;
B. 684,32 kJ;
C. 313,546 kJ;
D. 68,432 kJ.
Đáp án đúng là: C
C6H6 (l) + O2 (g) ⟶ 6CO2 (g) + 3H2O (g)
=
=
= − 3135,46 (kJ)
Do đó, đốt cháy 1 mol C6H6 thì lượng nhiệt sinh ra là 3135,46 kJ
7,8 gam C6H6 (l) có số mol là: = 0,1 (mol).
Vậy đốt cháy 0,1 mol C6H6 thì lượng nhiệt sinh ra là 3135,46.0,1 = 313,546 (kJ)
Câu 3. Cho phương trình nhiệt hóa học sau:
SO2 (g) + O2 (g) SO3 (g) = − 98,5 kJ
Lượng nhiệt giải phóng ra khi chuyển 76,8 gam SO2 (g) thành SO3 (g) là
A. 98,5 kJ;
B. 118,2 kJ;
C. 82,08 kJ;
D. 7564,8 kJ.
Đáp án đúng là: B
SO2 (g) + O2 (g) SO3 (g) = − 98,5 kJ
Theo phương trình nhiệt hóa học, ta có cứ chuyển 1 mol SO2 (g) thành SO3 (g) thì lượng nhiệt giải phóng là 98,5 kJ.
76,8 gam SO2 (g) có số mol là: = 1,2 (mol)
Vậy chuyển 76,8 gam SO2 (g) thành SO3 (g) thì lượng nhiệt giải phóng là:
98,5.1,2 = 118,2 (kJ)
Câu 4. Cho phản ứng có dạng: aA + bB ⟶ mM + nN
Công thức tính biến thiên enthalpy phản ứng theo enthalpy tạo thành là
A. =
B. =
C. =
D. =
Đáp án đúng là: A
Cho phản ứng có dạng: aA + bB ⟶ mM + nN
Công thức tính biến thiên enthalpy phản ứng theo enthalpy tạo thành là:
=
Câu 5. Cho phản ứng: NH3 (g) + HCl (g) ⟶ NH4Cl (s)
Biết = − 314,4 kJ/mol; = − 92,31 kJ/mol; = − 45,9 kJ/mol.
Biến thiên enthalpy chuẩn của phản ứng tính là
A. – 176,19 kJ;
B. – 314,4 kJ;
C. – 452,61 kJ;
D. 176,2 kJ;
Đáp án đúng là: A
Ta có: =
⇒ = (kJ)
Câu 6. Tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm và cho biết đây là phản ứng tỏa nhiệt hay thu nhiệt.
2Al (s) + Fe2O3 (s) 2Fe (s) + Al2O3 (s)
Biết của Fe2O3 (s) và Al2O3 (s) lần lượt là -825,5 kJ/mol; -1676 kJ/mol
A. = − 850,5 kJ, phản ứng tỏa nhiệt;
B. = − 850,5 kJ, phản ứng thu nhiệt;
C. = − 2501,5 kJ, phản ứng tỏa nhiệt;
D. = − 2501,5 kJ, phản ứng thu nhiệt.
Đáp án đúng là: A
2Al (s) + Fe2O3 (s) 2Fe (s) + Al2O3 (s)
Ta có:
=
=
= − 850,5 (kJ)
Vậy = − 850,5 kJ < 0 nên phản ứng tỏa nhiệt.
Câu 7. Để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được
A. công thức phân tử của tất cả các chất trong phản ứng
B. công thức cấu tạo của tất cả các chất trong phản ứng
C. công thức đơn giản nhất của tất cả các chất trong phản ứng
D. Cả A, B và C đều sai
Đáp án đúng là: B
Ta có: = (cđ) – (sp)
Với (cđ); (sp) là tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
Do đó, để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được công thức cấu tạo của tất cả các chất trong phản ứng để xác định được số lượng và loại liên kết.
Câu 8. Tính của phản ứng đốt cháy 1 mol C2H2 (g) biết các sản phẩm thu được đều ở thể khí.
Cho enthalpy tạo thành chuẩn của các chất tương ứng là
|
Chất |
C2H2 (g) |
CO2 (g) |
H2O (g) |
|
(kJ/mol) |
+ 227 |
− 393,5 |
− 241,82 |
A. – 1270,6 kJ
B. − 1255,82 kJ
C. – 1218,82 kJ
D. – 1522,82 kJ
Đáp án đúng là: B
C2H2 (g) + O2 (g) ⟶2CO2 (g) + H2O (g)
của phản ứng đốt cháy 1 mol C2H2 (g) là
=
=
= − 1255,82 (kJ)
Câu 9. Sự phá vỡ liên kết cần ….. năng lượng, sự hình thành liên kết …... năng lượng.
Cụm từ tích hợp điền vào chỗ chấm trên lần lượt là
A. cung cấp, giải phóng;
B. giải phóng, cung cấp;
C. cung cấp, cung cấp;
D. giải phóng, giải phóng.
Đáp án đúng là: A
Sự phá vỡ liên kết cần cung cấp năng lượng, sự hình thành liên kết giải phóng năng lượng.
Câu 10. Cho phản ứng:
4HCl (g) + O2 (g) 2Cl2 (g) + 2 H2O (g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là bao nhiêu? Phản ứng tỏa nhiệt hay thu nhiệt?
A. = − 148 kJ, phản ứng tỏa nhiệt;
B. = − 148 kJ, phản ứng thu nhiệt;
C. = 215 kJ, phản ứng tỏa nhiệt;
D. = 215 kJ, phản ứng thu nhiệt.
Đáp án đúng là: A
4H − Cl (g) + O = O (g) 2Cl – Cl (g) + 2H – O – H (g)
Biến thiên enthalpy chuẩn của phản ứng là
=
=
=
= − 148 (kJ)
= − 148 kJ < 0 nên phản ứng tỏa nhiệt.
Câu 11. Cho phản ứng có dạng: aA (g) + bB (g) ⟶ mM (g) + nN (g)
Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết Eb là
A. =
B. =
C. =
D. =
Đáp án đúng là: B
Cho phản ứng có dạng: aA (g) + bB (g) ⟶ mM (g) + nN (g)
Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết là:
=
Trong đó, Eb(A), Eb(B), Eb(M), Eb(N) lần lượt là tổng năng lượng liên kết của tất cả các liên kết trong các phân tử A, B, M và N.
Câu 12. Số lượng mỗi loại liên kết trong phân tử CH3Cl là
A. 1 liên kết C – H, 1 liên kết C – Cl;
B. 3 liên kết C – H, 1 liên kết H – Cl;
C. 2 liên kết C – H, 1 liên kết C – Cl;
D. 3 liên kết C – H, 1 liên kết C – Cl.
Đáp án đúng là: B
Công thức cấu tạo của CH3Cl là:
Vậy trong 1 phân tử CH3Cl có 3 liên kết C – H, 1 liên kết C – Cl.
Câu 13. Cho phản ứng sau ở điều kiện chuẩn:
2H2 (g) + O2 (g) 2H2O (g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
A. – 506 kJ;
B. 428 kJ;
C. − 463 kJ;
D. 506 kJ.
Đáp án đúng là: A
2H – H (g) + O = O (g) 2H – O – H (g)
Biến thiên enthalpy chuẩn của phản ứng là
=
=
=
= − 506 (kJ)
Câu 14. Tính của phản ứng đốt cháy 21 gam CO (g) biết các sản phẩm thu được đều ở thể khí.
Cho enthalpy tạo thành chuẩn của các chất tương ứng là
|
Chất |
CO (g) |
CO2 (g) |
O2 (g) |
|
(kJ/mol) |
- 110,5 |
− 393,5 |
0 |
A. – 59,43 kJ;
B. – 283 kJ;
C. − 212,25 kJ;
D. – 3962 kJ.
Đáp án đúng là: C
CO (g) + O2 (g) ⟶ CO2 (g)
của phản ứng đốt cháy 1 mol CO (g) là
=
=
= − 283 (kJ)
21 gam CO có số mol là: nCO = = 0,75 (mol)
của phản ứng đốt cháy 21 gam CO (g) là: = − 212,25 (kJ)
Câu 15. Cho phương trình nhiệt hóa học sau:
2H2 (g) + O2 (g) ⟶ 2H2O (g) = − 483,64 kJ
So sánh đúng là
A. (cđ) >(sp);
B. (cđ) = (sp);
C. (cđ) <(sp);
D. (cđ) ≤ (sp).
Đáp án đúng là: A
Ta có: = (sp) – (cđ)
Với (cđ); (sp) là tổng enthalpy tạo thành ở điều kiện chuẩn của chất đầu và sản phẩm của phản ứng.
Xét phương trình nhiệt hóa học:
2H2 (g) + O2 (g) ⟶ 2H2O (g) = − 483,64 kJ
Ta thấy: = − 483,64 kJ < 0
Nên (sp) – (cđ) < 0
Do đó: (sp) <(cđ) hay (cđ) >(sp).
Phần 2: Lý thuyết Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
I. Xác định biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết
- Phản ứng hóa học xảy ra khi có sự phá vỡ các liên kết hóa học của chất đầu (cđ) và hình thành các liên kết hóa học của sản phẩm (sp). Sự phá vỡ các liên kết cần cung cấp năng lượng, sự hình thành các liên kết lại giải phóng năng lượng.
- Cho phản ứng tổng quát ở điều kiện chuẩn:
aA (g) + bB (g) → mM (g) + nN (g)
Tính của phản ứng khi biết các giá trị năng lượng liên kết (Eb) theo công thức:
Hay tổng quát:
Với ∑Eb (cđ); ∑Eb (sp): tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
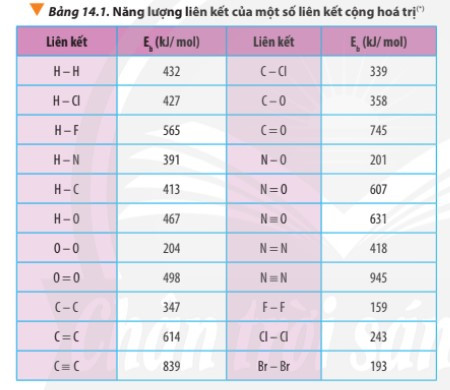
- Ví dụ: Dựa vào bảng năng lượng liên kết (phía trên) tính biến thiên enthalpy của phản ứng: 3H2(g) + N2(g) → 2NH3(g)
= 3.Eb(H2) + Eb(N2) – 2.Eb(NH3)
= 3.Eb(H-H) + Eb(N≡N) – 2.3.Eb(N-H)
= 3.432 + 945 – 2.3.391
= -105 kJ < 0 ⇒ Phản ứng tỏa nhiệt
Chú ý: Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết được áp dụng cho phản ứng trong đó các chất đều có liên kết cộng hóa trị ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
II. Xác định biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành
- Cho phương trình hóa học tổng quát:
aA + bB → mM + nN
- Tổng quát:
Với : tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của sản phẩm và chất đầu của phản ứng.
- Ví dụ: Tính ∆r phản ứng đốt cháy hoàn toàn benzene C6H6(l) trong khí oxygen.
C6H6(l) + O2(g) 6CO2(g) + 3H2O(l)
∆ r = 6.∆ f(CO2) + 3. ∆ f(H2O) - ∆ f(C6H6) - ∆ f(O2)
∆ r = 6.(-393,50) + 3.(-285,84) – (+49,00) - .0
∆ r = -3267,52 kJ