50 câu Trắc nghiệm Bài 8: Quy tắc octet (có đáp án 2024) – Hoá 10 Chân trời sáng tạo
Bộ 50 câu hỏi trắc nghiệm Hoá 10 (có đáp án) Bài 8: Quy tắc octet đầy đủ các mức độ sách Chân trời sáng tạo giúp học sinh ôn luyện trắc nghiệm Hoá 10 Bài 8.
Trắc nghiệm Hóa học 10 Bài 8: Quy tắc octet
Phần 1: Trắc nghiệm Bài 8: Quy tắc octet
Câu 1. Để đạt được quy tắc octet, nguyên tử potassium (Z= 19) phải nhường đi
A. 2 electron
B. 1 electron
C. 3 electron
D. 4 electron
Đáp án đúng là: B
potassium (Z= 19) có cấu hình electron là: 1s22s22p63s23p64s1
⇒ Có 1 electron lớp ngoài cùng.
Khí hiếm gần nhất là: Ar (Z = 18): 1s22s22p63s23p6
Do đó, nguyên tử potassium phải nhường đi 1 electron để đạt được cấu hình electron bền vững với 8 electron lớp ngoài cùng theo quy tắc octet.
Câu 2. Nguyên tử nguyên tố nào sau đây có xu hướng nhận thêm 2 electron khi hình thành liên kết hóa học?
A. Oxide
B. Neon
C. Carbon
D. Magnesium
Đáp án đúng là: A
Oxide (Z = 8) có cấu hình electron: 1s22s22p4 ⇒ có 6 electron lớp ngoài cùng ⇒ có xu hướng nhận 2 electron để đạt được cấu hình electron bền vững.
Neon (Z = 10) có cấu hình electron: 1s22s22p6 ⇒ có 8 electron lớp ngoài cùng ⇒ đây là cấu hình electron bền vững nên không có xu hướng nhường hoặc nhận electron.
Carbon (Z = 6) có cấu hình electron: 1s22s22p2 ⇒ có 4 electron lớp ngoài cùng ⇒ có xu hướng nhận 4 electron để đạt được cấu hình electron bền vững.
Magnesium (Z = 12) có cấu hình electron: 1s22s22p63s2⇒ có 2 electron lớp ngoài cùng ⇒ có xu hướng nhường 2 electron để đạt được cấu hình electron bền vững.
Câu 3. Nguyên tử X có điện tích hạt nhân là +20. Khi hình thành liên kết hóa học X có xu hướng
A. nhường 8 electron
B. nhận 6 electron
C. nhận 2 electron
D. nhường 2 electron
Đáp án đúng là: D
Nguyên tử X có điện tích hạt nhân là +20 ⇒ ZX = 20
⇒ cấu hình electron: 1s22s22p63s23p64s2⇒ có 2 elctron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron bền vững của khí hiếm gần nhất.
Câu 4. Để đạt được quy tắc octet, nguyên tử nitrogen (Z= 7) phải nhận thêm
A. 2 electron
B. 1 electron
C. 3 electron
D. 4 electron
Đáp án đúng là: C
Nitrogen (Z= 7) có cấu hình electron là: 1s22s22p3
⇒ Có 5 electron lớp ngoài cùng.
Khí hiếm gần nhất là: Ne (Z = 10): 1s22s22p6
Do đó, nguyên tử nitrogen phải nhận thêm 3 electron để đạt được cấu hình electron bền vững với 8 electron lớp ngoài cùng theo quy tắc octet.
Câu 5. Mô tả sự hình thành ion của nguyên tử S (Z = 16) theo quy tắc octet là
A. S + 2e ⟶ S2−
B. S ⟶ S2+ + 2e
C. S ⟶ S6+ + 6e
D. S ⟶ S2− + 2e
Đáp án đúng là: A
S (Z = 16) có cấu hình electron: 1s22s22p63s23p4 ⇒ Có 6 electron lớp ngoài cùng.
Khí hiếm gần nhất là: Ar (Z = 18): 1s22s22p63s23p6
Do đó, S có xu hướng nhận 2 electron để trở thành ion mang điện tích âm.
S + 2e ⟶ S2−
Câu 6. Ion lithium có cấu hình electron của khí hiếm tương ứng nào
A. He
B. Ne
C. Ar
D. Kr
Đáp án đúng là: A
Lithium (Z = 3): 1s22s1 ⇒ Có 1 electron lớp ngoài cùng.
Khí hiếm gần nhất là: He (Z = 2): 1s2
Do đó, nguyên tử Li có xu hướng nhường 1 electron để đạt được cấu hình electron bền vững.
Li ⟶ Li+ + 1e
1s22s11s2
Vậy ion lithium có cấu hình electron của khí hiếm He.
Câu 7. Ion aluminium có cấu hình electron của khí hiếm tương ứng nào
A. He
B. Ne
C. Ar
D. Kr
Đáp án đúng là: B
Aluminium (Z = 13): 1s22s22p63s23p1 ⇒ Có 3 electron lớp ngoài cùng.
Khí hiếm gần nhất là: Ne (Z = 10): 1s22s22p6
Do đó, nguyên tử Al có xu hướng nhường 3 electron để đạt được cấu hình electron bền vững.
Al ⟶ Al3+ + 3e
[Ne]3s23p1[Ne]
Vậy ion aluminium có cấu hình electron của khí hiếm Ne.
Câu 8. Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có
A. 8 electron tương ứng với khí hiếm gần nhất
B. 2 electron tương ứng với kim loại gần nhất
C. 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium)
D. 6 electron tương ứng với phi kim gần nhất
Đáp án đúng là: C
Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
Câu 9. Nguyên tử nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hóa học?
A. Fluorine
B. Oxygen
C. Hydrogen
D. Chlorine
Đáp án đúng là: D
Khí hiếm argon (Z = 18): 1s22s22p63s23p6
Fluorine (Z = 9): 1s22s22p5 có 7 electron lớp ngoài cùng. Xu hướng nhận thêm 1 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất là Ne: 1s22s22p6
Oxygen (Z = 8): 1s22s22p4 có 6 electron lớp ngoài cùng. Xu hướng nhận thêm 2 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất là Ne: 1s22s22p6
Hydrogen (Z = 1): 1s1 có 1 electron lớp ngoài cùng. Xu hướng nhận thêm 1 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất là He: 1s2
Chlorine (Z = 17): 1s22s22p63s23p5 có 7 electron lớp ngoài cùng. Xu hướng nhận thêm 1 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất là Ar: 1s22s22p63s23p6.
Vậy nguyên tử nguyên tố chlorine có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hóa học.
Câu 10. Mô tả sự hình thành ion của nguyên tử Mg (Z = 12) theo quy tắc octet là
A. Mg + 2e ⟶ Mg2−
B. Mg ⟶ Mg2+ + 2e
C. Mg + 6e ⟶ Mg6−
D. Mg + 2e ⟶ Mg2+
Đáp án đúng là: B
Mg (Z = 12) có cấu hình electron: 1s22s22p63s2 ⇒ Có 2 electron lớp ngoài cùng.
Khí hiếm gần nhất là: Ne (Z = 10): 1s22s22p6
Do đó, Mg có xu hướng nhường 2 electron lớp ngoài cùng để trở thành ion mang điện tích dương.
Mg ⟶ Mg2+ + 2e
Câu 11. Nguyên tử có cấu hình electron bền vững là
A. Na (Z = 11)
B. Cl (Z = 17)
C. Ne (Z = 10)
D. O (Z = 8)
Đáp án đúng là: C
Cấu hình electron bền vững là cấu hình electron với lớp ngoài cùng có 8 electron (trừ He với lớp electron ngoài cùng có 2 electron).
Na (Z = 11) có cấu hình electron: 1s22s22p63s1 ⇒ có 1 electron lớp ngoài cùng.
Cl (Z = 17) có cấu hình electron: 1s22s22p63s23p5 ⇒ có 7 electron lớp ngoài cùng.
Ne (Z = 10) có cấu hình electron: 1s22s22p6 ⇒ có 8 electron lớp ngoài cùng.
O (Z = 8) có cấu hình electron: 1s22s22p4 ⇒ có 6 electron lớp ngoài cùng.
Vậy Ne có 8 electron lớp ngoài cùng. Do đó Ne có cấu hình electron bền vững.
Câu 12. Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
A. Helium
B. Fluorine
C. Aluminium
D. Sodium
Đáp án đúng là: D
Helium (Z = 2) có cấu hình electron: 1s2 ⇒ là khí hiếm với 2 electron lớp ngoài cùng ⇒ đây là cấu hình electron bền vững nên không có xu hướng nhường hoặc nhận electron.
Fluorine (Z = 9) có cấu hình electron: 1s22s22p5 ⇒ có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt được cấu hình electron bền vững.
Aluminium (Z = 13) có cấu hình electron: 1s22s22p63s23p1 ⇒ có 3 electron lớp ngoài cùng ⇒ có xu hướng nhường 3 electron để đạt được cấu hình electron bền vững.
Sodium (Z = 11) có cấu hình electron: 1s22s22p63s1⇒ có 1 electron lớp ngoài cùng ⇒ có xu hướng nhường 1 electron để đạt được cấu hình electron bền vững.
Câu 13. Nguyên tử Y có 15 proton. Khi hình thành liên kết hóa học Y có xu hướng hình thành ion có cấu hình electron là
A. 1s22s22p63s23p3
B. 1s22s22p63s23p6
C. 1s22s22p6
D. 1s22s22p63s23p64s2
Đáp án đúng là: B
Nguyên tử Y có 15 proton ⇒ ZY = số proton = 15
Cấu hình electron của Y: 1s22s22p63s23p3 ⇒ có 5 electron lớp ngoài cùng, xu hướng nhận thêm 3 electron để đạt được cấu hình electron của khí hiếm gần nhất là Ar.
Do đó ion được tạo thành từ Y có cấu hình electron là: 1s22s22p63s23p6
Câu 14. Nguyên tử Y có 7 electron. Ion được tạo thành từ Y theo quy tắc octet có số electron, proton lần lượt là
A. 8 electron; 8 proton
B. 7 electron; 7 proton
C. 10 electron; 10 proton
D. 10 electron; 7 proton
Đáp án đúng là: D
Nguyên tử Y có 7 electron ⇒ số proton = số electron = 7.
Nguyên tử Y có 7 electron ⇒ cấu hình electron: 1s22s22p3 ⇒ có 5 elctron lớp ngoài cùng ⇒ xu hướng nhận 3 electron để đạt cấu hình electron bền vững của khí hiếm gần nhất (Ne).
X + 3e ⟶ X3−
Do đó ion X3− có 7 + 3 = 10 (electron); số proton không đổi là 7 proton.
Câu 15. Nguyên tử X có 9 electron. Ion được tạo thành từ X theo quy tắc octet có số electron là
A. 8 electron
B. 9 electron
C. 10 electron
D. 12 electron
Đáp án đúng là: C
Nguyên tử X có 9 electron ⇒ cấu hình electron: 1s22s22p5 ⇒ có 7 elctron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron bền vững của khí hiếm gần nhất.
X + 1e ⟶ X−
Do đó ion X− có 9 + 1 = 10 (electron)
Phần 2: Lý thuyết Bài 8: Quy tắc octet
I. Liên kết hóa học
- Phân tử được tạo nên từ các nguyên tử bằng liên kết hóa học.
Ví dụ:
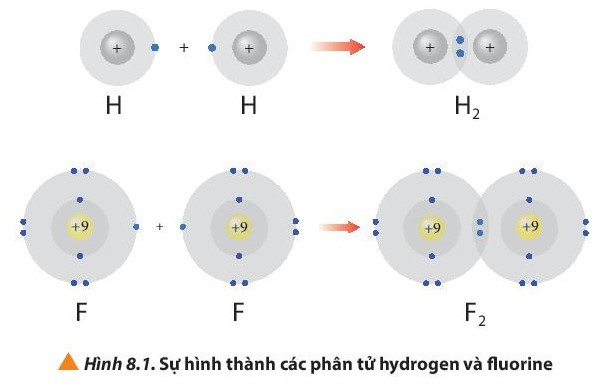
- Phân tử hydrogen (H2) được tạo nên bằng liên kết hóa học giữa hai nguyên tử hydrogen (H).
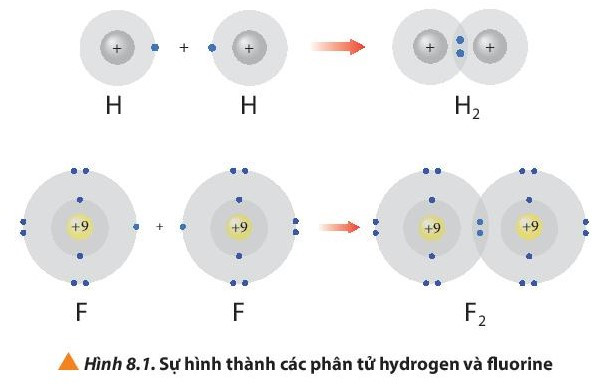
- Phân tử fluorine (F2) được tạo nên bằng liên kết hóa học giữa hai nguyên tử fluorine (F).
II. Quy tắc octet
- Quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
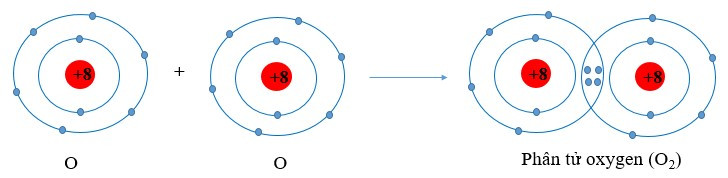
Ví dụ 1: Vận dụng quy tắc octet trong sự hình thành phân tử oxygen (O2)
Nguyên tử oxygen có 6 electron ở lớp ngoài cùng. Khi 2 nguyên tử O liên kết với nhau, mỗi nguyên tử O sẽ góp 2 electron để tạo 2 cặp electron dùng chung tạo thành cấu hình electron bền vững của khí hiếm neon.
Ví dụ 2: Vận dụng quy tắc octet trong sự tạo thành ion potassium (K+).
Nguyên tử potassium có 1 electron ở lớp ngoài cùng. Nếu mất đi 1 electron nguyên tử potassium sẽ đạt được cấu hình electron bền vững, giống với khí hiếm gần nhất là Ar.
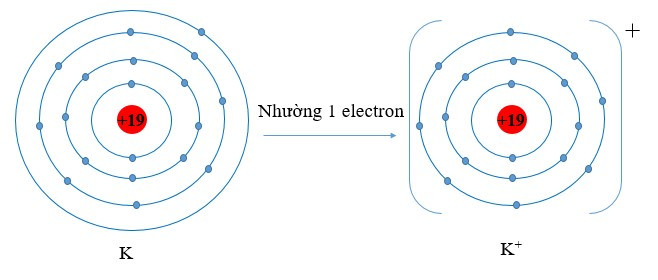
Viết gọn: K → K+ + 1e
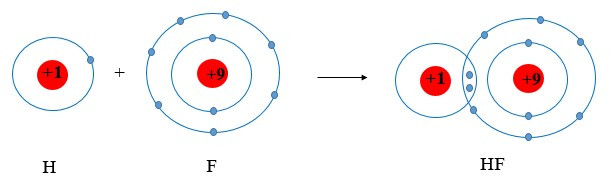
Ví dụ 3: Vận dụng quy tắc octet trong sự tạo thành phân tử HF.
+ Fluorine thuộc nhóm VIIA ⇒ có 7 electron lớp ngoài cùng.
+ Hydrogen thuộc nhóm IA ⇒ có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron)
⇒ Cả 2 có xu hướng nhận electron để đạt cấu hình electron của khí hiếm
⇒ Khi tham gia liên kết hình thành phân tử HF, mỗi nguyên tử sẽ gọp chung 1 electron để tạo thành cặp electron dùng chung.
Chú ý:
+ Không phải mọi trường hợp, nguyên tử của các nguyên tố khi tham gia liên kết đều tuân theo quy tắc octet. Người ta nhận thấy, một số phân tử có thể không tuân theo quy tắc octet như: NO; BH3; SF6 …
+ Với nguyên tử của các nguyên tố nhóm B, người ta áp dụng một số quy tắc khác, tương ứng với quy tắc octet, là quy tắc 18 electron để giải thích xu hướng khi tham gia liên kết hóa học của chúng.