Lý thuyết KHTN 7 ( Kết nối tri thức 2024 ) Bài 6: Giới thiệu về liên kết hóa học
Tóm tắt lý thuyết Bài 6: Giới thiệu về liên kết hóa học sách Khoa học tự nhiên 7 Kết nối tri thức ngắn gọn, chính xác sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt KHTN 7.
Nội dung bài viết
Xem thêm »
Khoa học tự nhiên lớp 7 Bài 6: Giới thiệu về liên kết hóa học
Video giải KHTN 7 Bài 6: Giới thiệu về liên kết hóa học - Kết nối tri thức
A. Lý thuyết KHTN 7 Bài 6: Giới thiệu về liên kết hóa học
I. Cấu trúc electron bền vững của khí hiếm
- Ở điều kiện thường, các khí hiếm tồn tại dưới dạng đơn nguyên tử bền vững, khó bị biến đổi hóa học. Lớp electron ngoài cùng của chúng chứa 8 electron (trừ He chứa 2 electron).
- Nguyên tử của các nguyên tố khác có xu hướng tham gia liên kết hóa học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung electron.
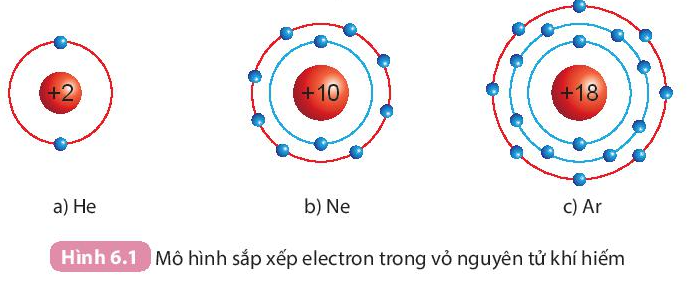
II. Liên kết ion
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Khi kim loại tác dụng với phi kim, nguyên tử kim loại nhường electron cho nguyên tử phi kim. Nguyên tử kim loại trở thành ion dương và nguyên tử phi kim trở thành ion âm. Các ion dương và âm hút nhau tạo thành liên kết trong hợp chất ion.
Ví dụ: Sự hình thành liên kết trong phân tử muối ăn (NaCl)
+ Nguyên tử sodium (Na) nhường một electron ở lớp electron ngoài cùng cho nguyên tử chlorine (Cl) đề tạo thành ion dương Na+ có vỏ bền vững giống vỏ nguyên tử khí hiếm He.
+ Nguyên tử Cl nhận vào lớp electron ngoài cùng một electron của nguyên tử Na để tạo thành ion âm Cl- có vỏ bền vững giống vỏ nguyên tử khí hiếm Ar.
+ Hai ion được tạo thành mang điện tích ngược dấu hút nhau để hình thành liên kết ion trong phân tử muối ăn.
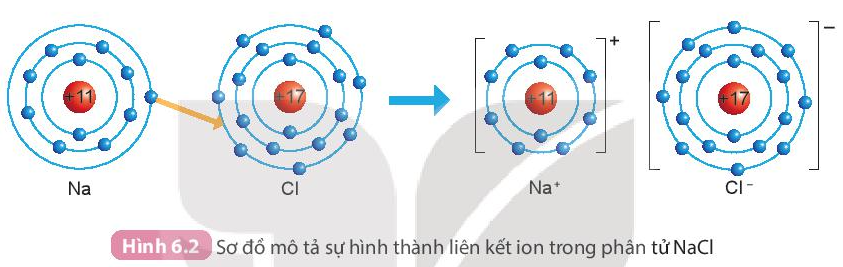
- Liên kết ion thường được tạo thành giữa kim loại điển hình và phi kim điển hình.
+ Các hợp chất ion như muối ăn … là chất rắn ở điều kiện thường, khó bay hơi, khó nóng chảy và khi tan trong nước tạo thành dung dịch dẫn được điện.
III. Liên kết cộng hóa trị
Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
1. Liên kết công hóa trị trong phân tử đơn chất
- Liên kết cộng hóa trị thường gặp trong nhiều phân tử đơn chất phi kim như nitrogen, chlorine, fluorine,…
Ví dụ:
- Sự hình thành phân tử hydrogen
+ Mỗi nguyên tử H có một electron ở lớp ngoài cùng.
+ Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử hydrogen, hai nguyên tử H đã liên kết với nhau bằng cách mỗi nguyên tử H góp chung 1 electron tạo thành 1 cặp electron dùng chung.
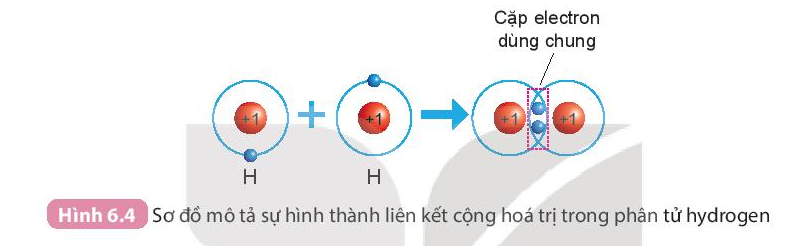
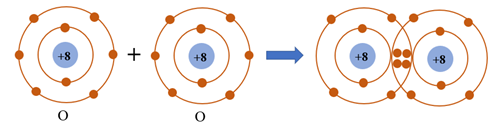
- Sự hình thành phân tử oxygen
- Mỗi nguyên tử O có 6 electron ở lớp ngoài cùng.
- Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử oxygen, hai nguyên tử O đã liên kết với nhau bằng cách mỗi nguyên tử O góp chung 2 electron để tạo thành 2 cặp electron dùng chung.
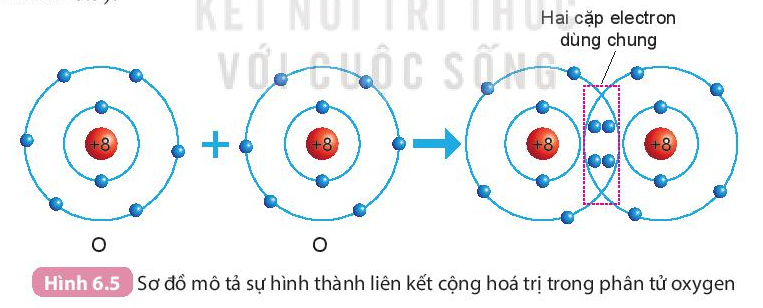
2. Liên kết cộng hóa trị trong phân tử hợp chất
Ví dụ: Sự hình thành phân tử nước:
Khi hình thành phân tử nước, hai nguyên tử H đã liên kết với 1 nguyên tử O bằng cách nguyên tử O góp chung với mỗi nguyên tử H một electron tạo thành cặp electron dùng chung.
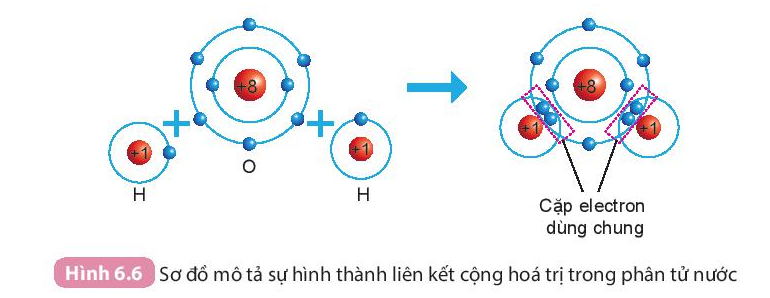
- Các chất hydrogen, oxygen và nước, carbon dioxide, ammonia,… chỉ chứa các liên kết cộng hóa trị, được gọi là chất cộng hóa trị.
- Các chất cộng hóa trị có thể là chất rắn, chất lỏng hoặc chất khí;
+ Các chất cộng hóa trị thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Bảng so sánh một số tính chất của chất ion với chất cộng hóa trị
|
Tính chất |
Chất ion |
Chất cộng hóa trị |
|
Trạng thái (ở điều kiện thường) |
Thể rắn |
Cả ba thể (rắn, lỏng, khí) |
|
Nhiệt độ sôi, nhiệt độ nóng chảy |
Cao |
Thấp |
|
Dẫn điện |
Tan trong nước tạo dung dịch dẫn được điện |
Nhiều chất không dẫn điện (đường ăn, ethanol,…) |
B. Bài tập trắc nghiệm KHTN 7 Bài 6: Giới thiệu về liên kết hóa học
Câu 1. Trong phân tử oxygen, khi hai nguyên tử oxygen liên kết với nhau, chúng
A. góp chung proton.
B. chuyển electron từ nguyên tử này sang nguyên tử kia.
C. chuyển proton từ nguyên tử này sang nguyên tử kia.
D. góp chung electron.
Đáp án: D
Giải thích: Mỗi nguyên tử O có 6 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử oxygen, hai nguyên tử O đã liên kết với nhau bằng cách mỗi nguyên tử O góp chung 2 electron tạo thành cặp electron dùng chung.
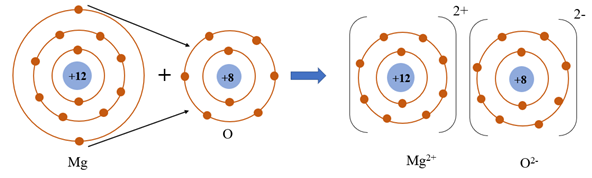
Câu 2. Trong phân tử MgO, nguyên tử Mg (magnesium) và nguyên tử O (oxygen) liên kết với nhau bằng liên kết
A. cộng hóa trị.
B. ion.
C. kim loại.
D. phi kim.
Đáp án: B
Giải thích: Trong phân tử MgO, nguyên tử Mg (magnesium) và nguyên tử O (oxygen) liên kết với nhau bằng liên kết ion. Nguyên tử Mg nhường 2 electron ở lớp electron ngoài cùng cho nguyên tử O để tạo thành ion dương Mg2+. Nguyên tử O nhận vào lớp electron ngoài cùng 2 electron của nguyên tử Mg để tạo thành ion âm O2-. Hai ion Mg2+ và O2- được tạo thành mang điện tích ngược dấu hút nhau để hình thành liên kết ion trong phân tử MgO.
Câu 3. Nhận định nào sau đây sai?
A. Các chất cộng hóa trị có thể là chất lỏng, chất rắn hay chất khí.
B. Các chất cộng hóa trị thường có nhiệt độ nóng chảy và nhiệt độp sôi thấp.
C. Các chất cộng hóa trị thường dễ bay hơi.
D. Các chất cộng hóa trị thường có nhiệt độ nóng chảy cao hơn các chất ion.
Đáp án: D
Giải thích:
Các chất cộng hóa trị có thể là chất lỏng, chất rắn hay chất khí → A đúng.
Các chất cộng hóa trị thường có nhiệt độ nóng chảy và nhiệt độp sôi thấp → B đúng.
Các chất cộng hóa trị thường có nhiệt độ sôi thấp do đó chúng dễ bay hơi → C đúng.
Các chất cộng hóa trị thường có nhiệt độ nóng chảy thấp. Trong khi đó, các hợp chất ion thường khó nóng chảy. Vậy các chất cộng hóa trị thường có nhiệt độ nóng chảy thấp hơn các chất ion → D sai.
Câu 4. Khẳng định nào sau đây là sai?
A. Muối ăn ở trạng thái rắn dẫn điện.
B. Ở điều kiện thường, muối ăn khó bay hơi, khó nóng chảy.
C. Dung dịch muối ăn dẫn được điện.
D. Trong phân tử muối ăn, liên kết giữa ion Na+ và ion Cl- là liên kết ion.
Đáp án: A
Giải thích:
Muối ăn ở trạng thái rắn không dẫn điện. Khi muối ăn tan trong nước tạo thành dung dịch dẫn được điện → A sai và C đúng.
Các hợp chất ion như muối ăn là chất rắn ở điều kiện thường, khó bay hơi, khó nóng chảy → B đúng.
Trong phân tử muối ăn, liên kết giữa ion Na+ và ion Cl- là liên kết ion → D đúng.
Câu 5. Liên kết giữa các nguyên tử trong phân tử nước là liên kết
A. kim loại.
B. ion.
C. cộng hóa trị.
D. phi kim.
Đáp án: C
Giải thích: Liên kết giữa các nguyên tử trong phân tử nước là liên kếtcộng hóa trị. Khi hình thành phân tử nước, hai nguyên tử H đã liên kết với một nguyên tử O bằng cách nguyên tử O góp chung với mỗi nguyên tử H một electron tạo thành cặp electron dùng chung.
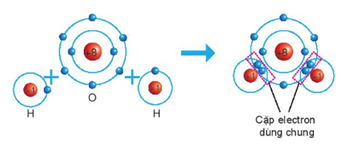
Câu 6. Phát biểu nào sau đây sai?
A. Liên kết ion được hình thành bởi lực hút giữa các ion mang điện tích trái dấu.
B. Liên kết cộng hóa trị được tạo nên do sự dùng chung một hay nhiều electron.
C. Nguyên tử khí hiếm có lớp electron ngoài cùng bền vững (8 electron).
D. Khi tham gia liên kết hóa học, các nguyên tử đạt được lớp electron ngoài cùng bền vững giống khí hiếm.
Đáp án: B
Giải thích: B sai vì liên kết cộng hóa trị được tạo nên do sự dùng chung một hay nhiều cặp electron.
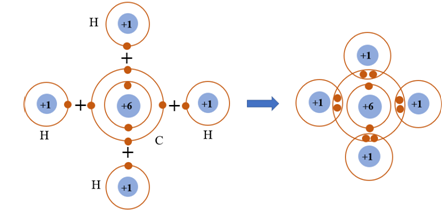
Câu 7. Phân tử methane gồm một nguyên tử carbon liên kết với bốn nguyên tử hydrogen. Khi hình thành liên kết cộng hóa trị trong methane, nguyên tử carbon góp chung bao nhiêu electron với mỗi nguyên tử hygrogen?
A. Nguyên tử carbon góp chung 1 electron với mỗi nguyên tử hygrogen.
B. Nguyên tử carbon góp chung 2 electron với mỗi nguyên tử hygrogen.
C. Nguyên tử carbon góp chung 3 electron với mỗi nguyên tử hygrogen.
D. Nguyên tử carbon góp chung 4 electron với mỗi nguyên tử hygrogen.
Đáp án: A
Giải thích: Mỗi nguyên tử carbon có 4 electron ở lớp ngoài cùng, mỗi nguyên tử hydrogen có 1 electron ở lớp ngoài cùng. Để có cấu trúc bền vững của khí hiếm, khi hình thành phân tử methane, bốn nguyên tử hydrogen đã liên kết với một nguyên tử carbon bằng cách nguyên tử carbon góp chung với mỗi nguyên tử hygrogen 1 electron tạo thành cặp electron dùng chung.
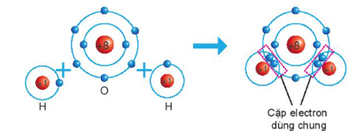
Câu 8. Liên kết hóa học giữa các nguyên tử oxygen và hydrogen trong phân tử nước được hình thành bằng cách
A. nguyên tử oxygen nhận electron, nguyên tử hydrogen nhường electron.
B. nguyên tử oxygen nhường electron, nguyên tử hydrogen nhận electron.
C. nguyên tử oxygen và hydrogen góp chung electron.
D. nguyên tử oxygen và hydrogen góp chung proton.
Đáp án: C
Giải thích: Khi hình thành phân tử nước, hai nguyên tử H đã liên kết với một nguyên tử O bằng cách nguyên tử O góp chung với mỗi nguyên tử H một electron tạo thành cặp electron dùng chung.
Câu 9. Cho mô hình sắp xếp các electron trong vỏ nguyên tử Al (aluminum).
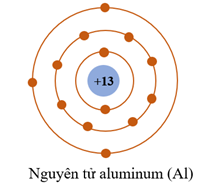
Khi tham gia hình thành liên kết ion, nguyên tử aluminum có xu hướng nhường đi 3 electron để tạo thành ion
A. Al+.
B. Al3-.
C. Al.
D. Al3+.
Đáp án: D
Giải thích: Khi tham gia hình thành liên kết ion, nguyên tử aluminum có xu hướng nhường đi 3 electron để tạo thành ion Al3+.
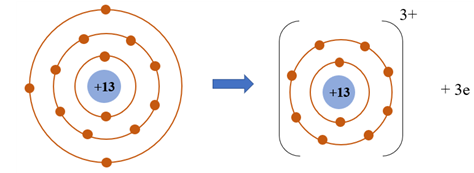
Câu 10. Cho mô hình sắp xếp các electron trong vỏ nguyên tử Na và nguyên tử Ne:
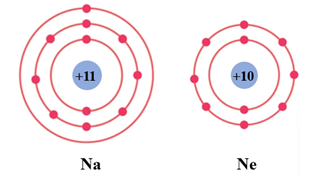
Để đạt được lớp vỏ bền vững giống vỏ nguyên tử khí hiếm Ne thì nguyên tử Na cần nhường hay nhận bao nhiêu electron?
A. nhường 1 electron.
B. nhường 7 electron.
C.nhận 1 electron.
D. nhận 7 electron.
Đáp án: A
Giải thích: Để đạt được lớp vỏ bền vững giống vỏ nguyên tử khí hiếm Ne thì nguyên tử Na cần nhường 1 electron.