30 câu Trắc nghiệm KHTN 8 (Cánh diều 2024) Bài 12: Muối có đáp án
Bộ 30 câu hỏi trắc nghiệm Bài 12: Muối môn KHTN 8 đầy đủ các mức độ sách Khoa học tự nhiên 8 (có đáp án) Cánh diều giúp học sinh ôn luyện trắc nghiệm KHTN 8 Bài 12.
Nội dung bài viết
Xem thêm »
Trắc nghiệm KHTN 8 Bài 12: Muối
Phần 1: 15 câu Trắc nghiệm KHTN 8 Bài 12: Muối
Câu 1. Muối ăn có công thức hoá học là
A. Na2SO4.
B. Na2CO3.
C. NaCl.
D. Na2S
Đáp án đúng là: C
Công thức hoá học của muối ăn là NaCl.
Câu 2. Muối nào sau đây không tan trong nước?
A. BaSO4.
B. CaSO4.
C. Ca(NO3)2.
D. CuSO4.
Đáp án đúng là: A
Muối không tan trong nước là BaSO4.
Câu 3. Điền vào chỗ trống: 'Muối là những hợp chất được tạo ra khi thay thế ion ... trong ... bằng ion kim loại hoặc ion ammonium ( NH+4).'
A. OH-, base.
B. OH-, acid.
C. H+, acid.
D. H+, base.
Đáp án đúng là: C
'Muối là những hợp chất được tạp ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH+4)”.
Câu 4. Công thức hoá học của muối có tên gọi calcium carbonate là
A.CaC2.
B. CaCO3.
C. CaSO4.
D. Ca(HCO3)2.
Đáp án đúng là: B
Công thức của calcium carbonate là CaCO3.
Câu 5. Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là
A. không có hiện tượng gì.
B. có khí thoát ra.
C. có kết tủa đỏ nâu.
D. có khí mùi hắc.
Đáp án đúng là: C
PTHH: 3KOH + FeCl3 → Fe(OH)3 + 3KCl
Phản ứng xuất hiện kết tủa màu nâu đỏ Fe(OH)3.
Câu 6. Hợp chất NaHSO4 có tên gọi là
A. sodium sulfate.
B. sodium sulfite.
C. sodium hydrogensulfate.
D. sodium sulfuric
Đáp án đúng là: C
Hợp chất NaHSO4 có tên gọi là sodium hydrogensulfate.
Câu 7. Cho phương trình hoá học:
BaCO3+2HCl→BaCl2+Y+H2O
Vậy chất Y là
A. CO.
B. H2.
C. Cl2.
D. CO2.
Đáp án đúng là: D
PTHH: BaCO3+2HCl→BaCl2+CO2+H2O
Câu 8. Hãy cho biết muối nào sau đây có thể điều chế bằng phản ứng của kim loại với dung dịch acid H2SO4 loãng?
A. ZnSO4.
B.AgSO4.
C. CuSO4
D. AgCl.
Đáp án đúng là: A
PTHH: Zn + H2SO4 → ZnSO4 + H2.
Câu 9. Cho dãy các chất: KCl, Cu(OH)2, BaO, MgCO3, ZnCl2, KOH, CuSO4, NH4NO3. Số lượng muối có trong dãy là
A. 3. B. 4.
C. 5. D. 6.
Đáp án đúng là: C
Các chất là muối có trong dãy: KCl; MgCO3; ZnCl2; CuSO4; NH4NO3.
Câu 10. Cho 35 gam CaCO3 vào dung dịch HCl dư, kết thúc phản ứng thu được bao nhiêu lít khí CO2 ở điều kiện chuẩn?
A. 7,84 lít.
B. 6,72 lít.
C. 8,68 lít.
D. 5,90 lít.
Đáp án đúng là: C
nCaCO3=35100=0,35 (mol)
PTHH: CaCO3+2HCl→CaCl2+H2O + CO2
Ta có: nCO2=nCaCO3=0,35 (mol)
⇒VCO2=n.24,79=0,35.24,79=8,68 (L)
Câu 11. Muối được sử dụng làm bột nở cho bánh quy xốp là muối nào sau đây?
A. Na2CO3
B. NaCl.
C. Na2SO4.
D. NH4HCO3
Đáp án đúng là: D
Muối được sử dụng làm bột nở cho bánh quy xốp là NH4HCO3 vì ở nhiệt độ cao muối này bị phân hủy hoàn toàn thành khí:
NH4HCO3to→NH3+CO2+H2O
Câu 12. Muối nào sau đây không tan trong nước?
A. KCl.
B. KNO3.
C. ZnCl2.
D. BaCO3.
Đáp án đúng là: D
Muối không tan trong nước là BaCO3.
Câu 13. Tính chất hóa học của muối là
A. tác dụng với kim loại.
B. tác dụng với acid.
C. Tác dụng với dung dịch base.
D. A, B, C đều đúng.
Đáp án đúng là: D
Tính chất hóa học của muối là tác dụng với kim loại; tác dụng với acid; tác dụng với dung dịch base; tác dụng với kim loại và tác dụng với muối.
Câu 14. Cho các phát biểu sau:
(1) Một số muối tác dụng với dung dịch acid tạo thành muối mới và acid mới.
(2) Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
(3) Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
(4) Phản ứng trung hòa không thuộc loại phản ứng trao đổi.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án đúng là: C
Các phát biểu đúng là:
(1) Một số muối tác dụng với dung dịch acid tạo thành muối mới và acid mới.
(2) Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
(3) Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
Câu 15. Trộn 2 dung dịch nào sau đây sẽ không xuất hiện kết tủa?
A. BaCl2, Na2SO4.
B. Na2CO3, Ba(OH)2.
C. BaCl2, AgNO3.
D. NaCl, K2SO4.
Đáp án đúng là: D
2 dung dịch NaCl và K2SO4 không phản ứng với nhau, do không thoả mãn điều kiện xảy ra phản ứng trao đổi trong dung dịch.
Phần 2: Lý thuyết KHTN 8 Bài 12: Muối
I. Khái niệm muối
Muối là những hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+).
Ví dụ: NaCl, K2SO4, Ca3(PO4)2, NH4NO3 …
II. Tên gọi của muối
Tên gọi muối của một số acid được trình bày trong bảng sau:
|
Acid |
Muối |
Ví dụ |
|
Hydrochloric acid (HCl) |
Muối chloride |
Sodium chloride: NaCl |
|
Sulfuric acid (H2SO4) |
Muối sulfate |
Copper(II) sulfate: CuSO4 |
|
Phosphoric acid (H3PO4) |
Muối phosphate |
Potassium phosphate: K3PO4 |
|
Carbonic acid (H2CO3) |
Muối carbonate |
Calcium carbonate: CaCO3 |
|
Nitric acid (HNO3) |
Muối nitrate |
Magnesium nitrate: Mg(NO3)2 |
III. Tính tan của muối
- Có muối tan tốt trong nước như: NaCl, CuSO4, Ca(NO3)2, …
- Có muối ít tan trong nước như: CaSO4, PbCl2, …
- Có muối không tan trong nước như: CaCO3, BaSO4, AgCl, …
- Tính tan của một số muối được trình bày trong bảng tính tan sau:
Bảng tính tan trong nước của một số muối
|
Gốc acid |
Các kim loại |
|||||||||||
|
K I |
Na I |
Ag I |
Mg II |
Ca II |
Ba II |
Zn II |
Pb II |
Cu II |
Fe II |
Fe III |
Al III |
|
|
− Cl |
t |
t |
k |
t |
t |
t |
t |
i |
t |
t |
t |
t |
|
− NO3 |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
|
= SO4 |
t |
t |
i |
t |
i |
k |
t |
k |
t |
t |
t |
t |
|
= CO3 |
t |
t |
k |
k |
k |
k |
k |
k |
- |
k |
- |
- |
|
≡ PO4 |
t |
t |
k |
k |
k |
k |
k |
k |
k |
k |
k |
k |
t: chất dễ tan trong nước
k: chất không tan (độ tan nhỏ hơn 0,01 g/100 g nước).
i: chất ít tan (độ tan nhỏ hơn 1 g/100 g nước).
(-): chất không tồn tại hoặc bị nước phân huỷ.
IV. Tính chất hoá học của muối
1. Tác dụng với kim loại
Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
Ví dụ:
2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Fe(NO3)2 + Cu → Cu(NO3)2 + Fe
2. Tác dụng với acid
Muối có thể tác dụng với dung dịch acid tạo thành muối mới và acid mới.
Ví dụ:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
3. Tác dụng với base
Muối có thể tác dụng với dung dịch base tạo thành muối mới và base mới.
Ví dụ:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
4. Tác dụng với muối
Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
Ví dụ:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓
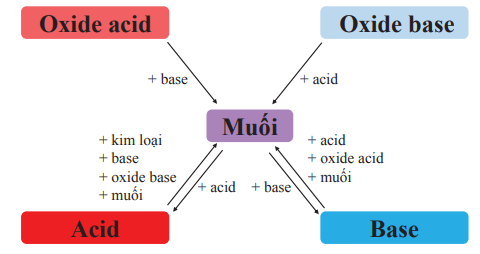
V. Mối quan hệ giữa acid, base, oxide và muối
Mối quan hệ giữa acid, base, oxide và muối được tóm tắt trong sơ đồ sau:
VI. Một số phương pháp điều chế muối
Muối có thể được tạo ra bằng các phương pháp sau:
- Cho dung dịch acid tác dụng với base. Ví dụ:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
- Cho dung dịch acid tác dụng với oxide base. Ví dụ:
3H2SO4 + Al2O3 → Al2(SO4)3 + 3H2O
- Cho dung dịch acid tác dụng với muối. Ví dụ:
2HCl + CaCO3 → CaCl2 + CO2↑ + H2O
- Cho dung dịch base tác dụng với oxide acid. Ví dụ:
2NaOH + CO2 → Na2CO3 + H2O
- Cho hai dung dịch muối tác dụng với nhau. Ví dụ:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl