Lý thuyết KHTN 8 (Kết nối tri thức 2024) Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
Tóm tắt lý thuyết Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học sách Khoa học tự nhiên 8 Kết nối tri thức ngắn gọn, chính xác sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt KHTN 8.
Nội dung bài viết
Xem thêm »
Lý thuyết KHTN 8 Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
A. Lý thuyết KHTN 8 Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
I. Định luật bảo toàn khối lượng
1. Nội dung định luật bảo toàn khối lượng
- Nội dung định luật: Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng các chất tham gia phản ứng.
- Thí nghiệm: Chuẩn bị dung dịch barium chloride, sodium sulfate, cản điện tử, cốc thuỷ tinh. Trên mặt cân đặt 2 cốc, ghi tổng khối lượng 2 cốc. Đổ cốc (1) vào cốc (2), quan sát thấy có một chất rắn màu trắng xuất hiện ở cốc (2). Đặt 2 cái trở lại cuặt cầu. So sánh tổng khối lượng của các chất trước phản ứng với tổng khối lượng các chất sau phản ứng.
- Giải thích: Trong các phản ứng hoá học, chỉ có liên kết giữa các nguyên tử thay đổi, còn số nguyên tử của mỗi nguyên tố hoá học vẫn giữ nguyên, vì vậy tổng khối lượng của các chất tham gia phản ứng bằng tổng khối lượng của các sản phẩm. Định luật này được hai nhà khoa học là Lomonosov và Lavoisier đưa ra vào thế kỉ XVIII.
2. Áp dụng định luật bảo toàn khối lượng
- Áp dụng định luật bảo toàn khối lượng:
Barium chloride + Sodium sulfate → Barium sulfate + Sodium chloride
- Biết khối lượng Barium chloride và Sodium sulfate đã phản ứng lần lượt là 20,8 gam và 14,2 gam, khối lượng của Barium sulfate tạo thành là 23,3 gam, ta sẽ xác định được khối lượng của Sodium chloride tạo thành là: 20,8 + 14,2 - 23,3 = 11,7(g).
- Tổng quát: Nếu trong phản ứng có n chất, khi biết khối lượng đã tham gia và tạo thành của (n - 1) chất, ta sẽ xác định được khối lượng của chất còn lại.
- Thành phần chính của than tổ ong là carbon. Sau khi đốt cháy than tổ ong, ta thu được xỉ than (tạp chất không cháy). Vì vậy, khối lượng của xỉ than sẽ nhẹ hơn khối lượng của than tổ ong ban đầu.
- Sau một thời gian không đậy nắp lọ đựng với sống (CaO), khối lượng của hỗn hợp sẽ tăng lên do CaO hút ẩm trong không khí tạo thành Ca(OH)2. Do đó, khối lượng của hỗn hợp sẽ tăng lên.
II. Phương trình hóa học
1. Lập Phương trình hóa học
- Phương trình hoá học của phản ứng giữa khí hydrogen và khí oxygen là:
2H2 + O2 → 2H2O
- Trong phản ứng hoá học, tổng số nguyên tử của mỗi nguyên tố trong các chất tham gia phản ứng luôn bằng tổng số nguyên tử của nguyên tố đó trong các chất sản phẩm. Sau khi cân bằng, tổng số nguyên tử của mỗi nguyên tố ở hai vẽ của sơ đồ phản ứng bằng nhau, ta được PTHH.
- Các bước lập phương trình hoá học:
Bước 1: Viết sơ đồ của phản ứng:
Al + O2→ Al2O3
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố ở 2 vế. Với trường hợp này, ta cần đặt hệ số 2 trước Al2O3 và hệ số 3 trước O2:
4Al + 3O2 →2Al2O3
Bước 3: Viết phương trình hoá học của phản ứng:
4Al + 3O2 →2Al2O3
Lưu ý:
- Hệ số viết ngang với kí hiệu của các chất.
- Không thay đổi các chỉ số trong các công thức hoá học đã viết đúng.
- Nếu trong công thức hoá học, các chất ở 2 vế có những nhóm nguyên tử giống nhau, ta coi nhóm nguyên tử này như một 'nguyên tố để cân bằng'.
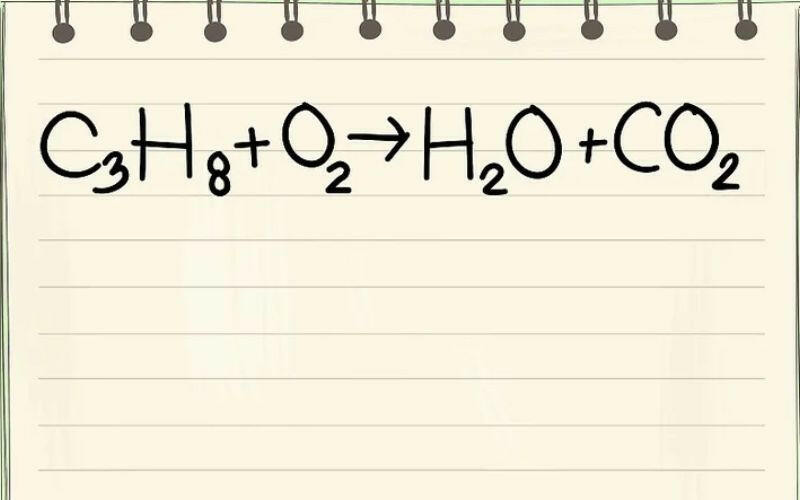
2. Ý nghĩa của phương trình hoá học
Phương trình hoá học thể hiện tỉ lệ số mol giữa các chất tham gia và sản phẩm trong một phản ứng hoá học. Từ đó, ta có thể xác định được tỉ lệ hệ số của các chất trong phản ứng và tỉ lệ số mol, cũng như tỉ lệ khối lượng của chúng. Ví dụ: Trong phản ứng 4Al + 3O2 --> 2Al2O3, ta biết được rằng để phản ứng hoàn toàn, cần sử dụng 4 mol nhôm với 3 mol oxi, tạo ra 2 mol nhôm oxit. Từ đó, ta có thể tính toán được tỉ lệ số mol và khối lượng giữa các chất trong phản ứng.
Sơ đồ tư duy KHTN 8 Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học

B. Bài tập trắc nghiệm KHTN 8 Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
Câu 1: Chọn khẳng định đúng trong các khẳng định sau?
A. Trong phản ứng hoá học, tổng khối lượng sản phẩm bằng tổng khối lượng các chất tham gia phản ứng.
B. Trong phản ứng hoá học, tổng khối lượng sản phẩm nhỏ hơn tổng khối lượng các chất tham gia phản ứng.
C. Tổng khối lượng sản phẩm lớn hơn tổng khối lượng các chất tham gia phản ứng.
D. Tổng khối lượng sản phẩm nhỏ hơn hoặc bằng tổng khối lượng các chất tham gia phản ứng.
Đáp án đúng là: A
Trong phản ứng hóa học, tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng sản phẩm tạo thành.
Câu 2. Cho sơ đồ phản ứng hoá học sau: NaI + Cl2 NaCl + I2
Tỉ lệ số phân tử NaI : số phân tử Cl2 : số phân tử NaCl : số phân tử I2 trong phương trình hoá học là
A. 2: 1: 2: 1.
B. 4: 1: 2: 2.
C. 1: 1: 2: 1.
D. 2: 2: 2: 1.
Đáp án đúng là: A
2NaI + Cl2 → 2NaCl + I2
Tỉ lệ số phân tử NaI : số phân tử Cl2 : số phân tử NaCl : số phân tử I2 trong phương trình hoá học là 2: 1: 2: 1.
Câu 3. Trong một phản ứng hoá học:
A. số nguyên tử của mỗi nguyên tố được bảo toàn.
B. số nguyên tử trong mỗi chất được bảo toàn.
C. số phân tử của mỗi chất không đổi.
D. số chất không đổi.
Đáp án đúng là: A
Trong một phản ứng hoá học: số nguyên tử của mỗi nguyên tố được bảo toàn.
Câu 4. Phương trình hoá học của phản ứng phosphorus cháy trong không khí (biết sản phẩm tạo thành là P2O5) là
A. P + O2 → P2O5.
B. 4P + 5O2 → 2P2O5.
C. P + 2O2 → P2O5.
D. P + O2 → P2O5.
Đáp án đúng là: B
Phương trình hoá học của phản ứng đốt cháy phosphorus trong không khí:
4P + 5O2 → 2P2O5.
Câu 5: Một vật thể bằng sắt (iron) để ngoài trời, sau một thời gian bị gỉ. Hỏi khối lượng của vật thay đổi thế nào so với khối lượng của vật trước khi bị gỉ?
A. Tăng.
B. Giảm.
C. Không thay đổi.
D. Không thể xác định được.
Đáp án đúng là: A
Một vật thể bằng sắt (iron) để ngoài trời, sau một thời gian bị gỉ là do sắt tác dụng với oxygen trong không khí tạo ra gỉ sắt. Khối lượng vật tăng lên do có thêm khối lượng của oxygen.
Câu 6. Cho sơ đồ phản ứng:
CO2 + Ba(OH)2 BaCO3 + ?
Cần điền chất nào sau đây để hoàn thành phương trình hoá học của phản ứng trên?
A. BaO.
B. H2O.
C. CO.
D. CH4.
Đáp án đúng là: B
CO2 + Ba(OH)2 → BaCO3 + H2O
Câu 7. Cho sơ đồ phản ứng:
?CO + Fe2O3 2Fe + ?CO2
Cần điền hệ số nào sau đây để hoàn thành PTHH của phản ứng trên?
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án đúng là: C
3CO + Fe2O3 → 2Fe + 3CO2
Câu 8: Phương trình hoá học nào sau đây là đúng?
A. N2 + 3H2 → NH3
B. N2 + H2 → NH3
C. N2 + 3H2 → 2NH3
D. N2 + H2 → 2NH3
Đáp án đúng là: C
Phương trình hoá học đúng là: N2 + 3H2 → 2NH3.
Câu 9: Nung đá vôi thu được sản phẩm là vôi sống và khí carbon dioxide. Kết luận nào sau đây là đúng?
A. Khối lượng đá vôi đem nung bằng khối lượng vôi sống tạo thành.
B. Khối lượng đá vôi bằng khối lượng khí carbon dioxide sinh ra.
C. Khối lượng đá vôi bằng khối lượng khí carbon dioxide cộng với khối lượng vôi sống.
D. Sau phản ứng khối lượng đá vôi tăng lên.
Đáp án đúng là: C
Ta có phản ứng: Đá vôi → Vôi sống + Khí carbon dioxide.
Theo định luật bảo toàn khối lượng: mđá vôi = mvôi sống + mkhí carbon dioxide.
Câu 10: Cho mẩu magnesium phản ứng với dung dịch hydrochloric acid. Chọn phát biểu không đúng?
A. Tổng khối lượng chất phản ứng lớn hơn khối lượng khí hydrogen.
B. Khối lượng của magneium chloride nhỏ hơn tổng khối lượng chất phản ứng
C. Khối lượng magnesium bằng khối lượng hydrogen.
D. Tổng khối lượng của các chất phản ứng bằng tổng khối lượng chất sản phẩm.
Đáp án đúng là: C
Do khối lượng của magnesium lớn hơn khối lượng của hydrogen.
Câu 11. Cho sơ đồ phản ứng:
2HCl + BaCO3 BaCl2 + H2O + ?
Cần điền chất nào sau đây để hoàn thành phương trình hoá học của phản ứng trên?
A. BaO.
B. Ba(OH)2.
C. CO.
D. CO2.
Đáp án đúng là: D
2HCl + BaCO3 → BaCl2 + H2O + CO2.
Câu 12. Cho 16,8 gam sắt (iron) cháy trong oxygen thu được 23,2 gam oxide. Khối lượng oxygen tham gia phản ứng cháy là?
A. 6,4 gam.
B. 40 gam.
C. 23,2 gam.
D. 10 gam.
Đáp án A.
Sắt + Oxygen → Oxide
Theo định luật bảo toàn khối lượng msắt + moxygen = moxide
⇒16,8 + moxygen = 23,2
Vậy moxygen = 6,4 gam.
Câu 13. Một lá sắt (iron) nặng 28 g để ngoài không khí, xảy ra phản ứng với oxygen, tạo ra gỉ sắt. Sau một thời gian, cân lại lá sắt, thấy khối lượng thu được là 31,2 g. Khối lượng khí oxygen đã phản ứng là
A. 3,2 g.
B. 1,6 g.
C. 6,4 g.
D. 24,8 g.
Đáp án đúng là: A
Áp dụng định luật bảo toàn khối lượng có:
Khối lượng lá sắt ban đầu + Khối lượng oxygen phản ứng = Khối lượng là sắt sau.
Vậy: Khối lượng oxygen đã phản ứng: 31,2 – 28 = 3,2 (gam).
Câu 14. Bạn Hạnh mua một cốc chứa 200 gam nước mía với thành phần đường mía chiếm 12% khối lượng, còn lại là nước. Có bao nhiêu gam nước trong cốc nước mía trên?
A. 200 gam.
B. 164 gam.
C. 176 gam.
D. 188 gam.
Đáp án đúng là: C
Khối lượng đường mía trong cốc là:
Áp dụng:
mnước mía = mnước + m đường mía ⇒ mnước = 200 – 24 = 176 gam.
Câu 15. Nung một lượng đá vôi (CaCO3) có khối lượng 12 g, thu được hỗn hợp rắn có khối lượng 8,4 g. Khối lượng của khí CO2 thoát ra là
A. 3,6 g.
B. 2,8 g.
C. 1,2 g.
D. 2,4 g.
Đáp án đúng là: A
Áp dụng định luật bảo toàn khối lượng:
Khối lượng đá vôi = Khối lượng chất rắn sau + Khối lượng CO2 thoát ra.
Vậy khối lượng CO2 thoát ra là: 12 – 8,4 = 3,6 (gam).