30 câu Trắc nghiệm KHTN 7 (Cánh diều 2024) Bài 2: Nguyên tố hoá học có đáp án
Bộ 30 câu hỏi trắc nghiệm Bài 2: Nguyên tố hoá học đầy đủ các mức độ sách Khoa học tự nhiên 7 (có đáp án) Cánh diều giúp học sinh ôn luyện trắc nghiệm KHTN 7 Bài 2.
Trắc nghiệm KHTN 7 Bài 2: Nguyên tố hoá học
Phần I. Bài tập trắc nghiệm KHTN 7 Bài 2: Nguyên tố hóa học
Câu 1. Cấu tạo bảng tuần hoàn gồm
A. Ô nguyên tố;
B. Chu kì;
C. Nhóm;
D. Cả A, B và C.
Đáp án: D
Giải thích:
Cấu tạo bảng tuần hoàn gồm:
- Ô nguyên tố;
- Chu kì;
- Nhóm;
Câu 2. Số thứ thự nhóm A bằng
A. số electron trong nguyên tử của các nguyên tố thuộc nhóm đó;
B. số lớp electron trong nguyên tử của các nguyên tố thuộc nhóm đó;
C. số electron lớp ngoài cùng trong nguyên tử của các nguyên tố thuộc nhóm đó;
D. số hiệu nguyên tử của nguyên tố thuộc nhóm đó.
Đáp án: C
Giải thích:
Số thứ thự nhóm A bằng số electron lớp ngoài cùng trong nguyên tử của các nguyên tố thuộc nhóm đó.
Câu 3. Số hiệu nguyên tử Z là số thứ tự của
A. Chu kì;
B. Ô nguyên tố;
C. Nhóm;
D. Cả A, B và C đều sai.
Đáp án: B
Giải thích:
Số hiệu nguyên tử Z là số thứ tự của ô nguyên tố trong bảng tuần hoàn.
Câu 4. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân
A. mở đầu chu kì là một kim loại điển hình (trừ chu kì 1), cuối chu kì là một phi kim điển hình và kết thúc chu kì là một khí hiếm;
B. mở đầu chu kì là một phi kim điển hình, cuối chu kì là một kim loại điển hình và kết thúc chu kì là một khí hiếm;
C. mở đầu chu kì là một khí hiếm (trừ chu kì 1), cuối chu kì là một phi kim điển hình và kết thúc chu kì là một kim loại điển hình;
D. mở đầu chu kì là một phi kim điển hình, cuối chu kì là một khí hiếm và kết thúc chu kì là một kim loại điển hình.
Đáp án: A
Giải thích:
Trong một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân: mở đầu chu kì là một kim loại điển hình (trừ chu kì 1), cuối chu kì là một phi kim điển hình và kết thúc chu kì là một khí hiếm.
Câu 5. Chu kì gồm
A. các nguyên tố mà nguyên tử có cùng số lớp electron;
B. các nguyên tố có tính chất hóa học tương tự nhau;
C. các nguyên tố mà nguyên tử có cùng số proton;
D. các nguyên tố mà nguyên tử có cùng số electron lớp ngoài cùng.
Đáp án: A
Giải thích:
Chu kì gồm các nguyên tố mà nguyên tử có cùng số lớp electron và được xếp thành hàng theo chiều tăng dần của điện tích hạt nhân.
Câu 6. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn là
A. Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử;
B. Các nguyên tố được xếp trong cùng một hàng có cùng số lớp electron trong nguyên tử;
C. Các nguyên tố trong cùng một cột có tính chất hóa học tương tự nhau;
D. Cả A, B và C.
Đáp án: D
Giải thích:
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn là:
- Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử;
- Các nguyên tố được xếp trong cùng một hàng có cùng số lớp electron trong nguyên tử;
- Các nguyên tố trong cùng một cột có tính chất hóa học tương tự nhau;
Câu 7. Khẳng định sai là
A. Các nguyên tố hóa học được chia thành 3 loại: kim loại, phi kim và khí hiếm;
B. Các nguyên tố nhóm IA, IIA và IIIA là kim loại (trừ hydrogen và boron);
C. Các nguyên tố ở nhóm VA, VIA là phi kim;
D. Các nguyên tố ở nhóm VIIIA là khí hiếm.
Đáp án: C
Giải thích:
Trong các nhóm VA, VIA ở phía cuối nhóm vẫn có các nguyên tố kim loại.
Vì vậy, ta chỉ khẳng định: Hầu hết các nguyên tố ở nhóm VA, VIA là phi kim.
Do đó, khẳng định C sai.
Câu 8. Biết nguyên tử nguyên tố X có 3 lớp electron và 1 electron lớp ngoài cùng. Vị trí của X trong bảng tuần hoàn là
A. ô thứ 11, chu kì 1, nhóm IIIA;
B. ô thứ 10, chu kì 3, nhóm IA;
C. ô thứ 10, chu kì 2, nhóm IIIA;
D. ô thứ 11, chu kì 3, nhóm IA.
Đáp án: D
Giải thích:
Ta có: Số thứ tự chu kì = số lớp electron;
Số thứ tự nhóm A = số electron lớp ngoài cùng;
Số thứ tự ô nguyên tố = số hiệu nguyên tử Z = số electron.
Do đó, X có 3 lớp electron nên X ở chu kì 3; 1 electron lớp ngoài cùng nên ở nhóm IA.
Mà lớp thứ nhất có tối đa 2 electron, lớp thứ 2 có tối đa 8 electron, lớp thứ 3 ngoài cùng có 1 electron nên X có 2 + 8 + 1 = 11 electron. Vậy X ở ô thứ 11.
Câu 9. Bảng tuần hoàn hiện nay gồm
A. 118 nguyên tố, 7 chu kì và 18 nhóm;
B. 108 nguyên tố, 8 chu kì và 18 cột;
C. 118 nguyên tố, 7 chu kì và 18 cột;
D. 108 nguyên tố, 8 chu kì và 8 nhóm.
Đáp án: C
Giải thích:
Bảng tuần hoàn hiện nay gồm 118 nguyên tố; 7 chu kì được đánh số từ 1 đến 7; và 18 cột trong đó có 8 cột nhóm A (đánh số thứ tự từ IA đến VIIIA) và 10 cột nhóm B.
Câu 10. Cho nguyên tố Y có số hiệu nguyên tử là 18. Dựa vào bảng tuần hoàn hãy xác định thông tin nào dưới đây sai?
A. Y có tên là argon, kí hiệu hóa học là Ar;
B. Y ở ô thứ 18, chu kì 3;
C. Y ở nhóm VIIIA;
D. Y là một phi kim điển hình.
Đáp án: D
Giải thích:
Thông tin sai là D.
Vì Y ở nhóm VIIIA mà nhóm VIIIA là nhóm các nguyên tố khí hiếm. Do đó Y là một nguyên tố khí hiếm.
Phần II. Lý thuyết KHTN 7 Bài 2: Nguyên tố hóa học
I. Nguyên tố hóa học là gì?
- Nguyên tố hóa học là tập hợp những nguyên tử có cùng số proton trong hạt nhân.
Ví dụ: Hình vẽ dưới đây mô tả những nguyên tử khác nhau có cùng 1 proton nên thuộc cùng một nguyên tố hydrogen.
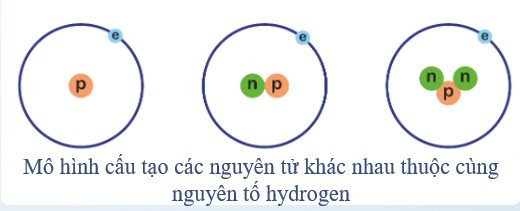
- Nguyên tố hóa học đặc trưng bởi số proton trong nguyên tử.
- Các nguyên tử của cùng một nguyên tố đều có chung tính chất hóa học.
- Cho đến nay, Liên minh Quốc tế về Hóa học thuần túy và Hóa học ứng dụng (IUPAC) đã công bố tìm thấy 118 nguyên tố hóa học gồm:
+ 90 nguyên tố trong tự nhiên
+ Số còn lại do con người tổng hợp, được gọi là nguyên tố nhân tạo
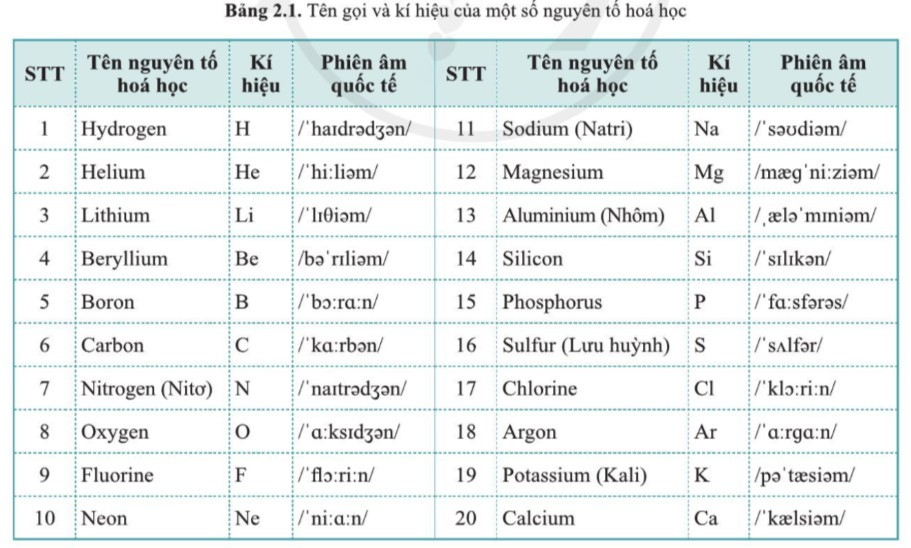
II. Tên nguyên tố hóa học
- Mỗi nguyên tố hóa học đều có tên riêng.
- Một số cách đặt tên nguyên tố hóa học khác nhau:
+ Dựa vào tính chất và ứng dụng của nguyên tố.
Ví dụ: Tên nguyên tố lithium, bắt nguồn từ tiếng Hy Lạp, “lithos” nghĩa là đá.
Tên nguyên tố carbon (thành phần chính là than) bắt nguồn từ tiếng La – tinh, “carbo” nghĩa là than.
Tên nguyên tố hydrogen bắt nguồn từ tiếng Hy Lạp, nghĩa là tạo ra nước.
+ Theo tên các nhà khoa học.
Ví dụ: Tên nguyên tố Gadolini, tên gọi của nhà hóa học người Phần Lan Iogana Gagolina.
Tên nguyên tố mendelevium bắt nguồn từ tên nhà hóa học người Nga Đ.I. Men-đê-lê-ép.
+ Theo tên địa danh.
Ví dụ: Tên nguyên tố Germani, tên gọi để kỉ niếm nước Đức (Germanie).
Tên nguyên tố polonium bắt nguồn tùa tên đất nước Balan (Poland).
- Có 13 nguyên tố hóa học đã quen dùng trong đời sống của người Việt Nam là: vàng (gold), bạc (silver), đồng (copper), chì (lead), sắt (iron), nhôm (aluminium), kẽm (zinc), lưu huỳnh (sulfur), thiếc (tin), nitơ (nitrogen), natri (sodium), kali (potassium) và thủy ngân (mercury). Vì vậy, trong thực tế, các nguyên tố này được dùng cả tên tiếng Việt và tên tiếng Anh để tiện tra cứu.
III. Kí hiệu hóa học
- Mỗi nguyên tố hóa học được biểu diễn bằng một kí hiệu riêng, được gọi là kí hiệu hóa học của nguyên tố.
- Cách biểu diễn kí hiệu hóa học:
+ Biểu diễn bằng một hay hai chữ cái trong tên nguyên tố.
+ Chữ cái đầu tiên được viết in hoa, chữ cái thứ hai (nếu có) được viết thường.
- Ví dụ:
+ Kí hiệu hóa học của nguyên tố Bromine là Br;
+ Kí hiệu hóa học của nguyên tố sulfur là S;
+ Kí hiệu hóa học của nitrogen là N,…
- Trong một số trường hợp, kí hiệu hóa học của nguyên tố không tương ứng với tên theo IUPAC. Ví dụ: Kí hiệu nguyên tố sodium là Na; Kí hiệu của nguyên tố iron là Fe,…