30 câu Trắc nghiệm KHTN 7 (Cánh diều 2024) Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học có đáp án
Bộ 30 câu hỏi trắc nghiệm Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học đầy đủ các mức độ sách Khoa học tự nhiên 7 (có đáp án) Cánh diều giúp học sinh ôn luyện trắc nghiệm KHTN 7 Bài 3.
Nội dung bài viết
Xem thêm »
Trắc nghiệm KHTN 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Phần I. Bài tập trắc nghiệm KHTN 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Câu 1. Bảng tuần hoàn hiện nay gồm
A. 118 nguyên tố, 7 chu kì và 18 nhóm;
B. 108 nguyên tố, 8 chu kì và 18 cột;
C. 118 nguyên tố, 7 chu kì và 18 cột;
D. 108 nguyên tố, 8 chu kì và 8 nhóm.
Đáp án: C
Giải thích:
Bảng tuần hoàn hiện nay gồm 118 nguyên tố; 7 chu kì được đánh số từ 1 đến 7; và 18 cột trong đó có 8 cột nhóm A (đánh số thứ tự từ IA đến VIIIA) và 10 cột nhóm B.
Câu 2. Biết nguyên tử nguyên tố X có 3 lớp electron và 1 electron lớp ngoài cùng. Vị trí của X trong bảng tuần hoàn là
A. ô thứ 11, chu kì 1, nhóm IIIA;
B. ô thứ 10, chu kì 3, nhóm IA;
C. ô thứ 10, chu kì 2, nhóm IIIA;
D. ô thứ 11, chu kì 3, nhóm IA.
Đáp án: D
Giải thích:
Ta có: Số thứ tự chu kì = số lớp electron;
Số thứ tự nhóm A = số electron lớp ngoài cùng;
Số thứ tự ô nguyên tố = số hiệu nguyên tử Z = số electron.
Do đó, X có 3 lớp electron nên X ở chu kì 3; 1 electron lớp ngoài cùng nên ở nhóm IA.
Mà lớp thứ nhất có tối đa 2 electron, lớp thứ 2 có tối đa 8 electron, lớp thứ 3 ngoài cùng có 1 electron nên X có 2 + 8 + 1 = 11 electron. Vậy X ở ô thứ 11.
Câu 3. Số thứ thự nhóm A bằng
A. số electron trong nguyên tử của các nguyên tố thuộc nhóm đó;
B. số lớp electron trong nguyên tử của các nguyên tố thuộc nhóm đó;
C. số electron lớp ngoài cùng trong nguyên tử của các nguyên tố thuộc nhóm đó;
D. số hiệu nguyên tử của nguyên tố thuộc nhóm đó.
Đáp án: C
Giải thích:
Số thứ thự nhóm A bằng số electron lớp ngoài cùng trong nguyên tử của các nguyên tố thuộc nhóm đó.
Câu 4. Số hiệu nguyên tử Z là số thứ tự của
A. Chu kì;
B. Ô nguyên tố;
C. Nhóm;
D. Cả A, B và C đều sai.
Đáp án: B
Giải thích:
Số hiệu nguyên tử Z là số thứ tự của ô nguyên tố trong bảng tuần hoàn.
Câu 5. Chu kì gồm
A. các nguyên tố mà nguyên tử có cùng số lớp electron;
B. các nguyên tố có tính chất hóa học tương tự nhau;
C. các nguyên tố mà nguyên tử có cùng số proton;
D. các nguyên tố mà nguyên tử có cùng số electron lớp ngoài cùng.
Đáp án: A
Giải thích:
Chu kì gồm các nguyên tố mà nguyên tử có cùng số lớp electron và được xếp thành hàng theo chiều tăng dần của điện tích hạt nhân.
Câu 6. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân
A. mở đầu chu kì là một kim loại điển hình (trừ chu kì 1), cuối chu kì là một phi kim điển hình và kết thúc chu kì là một khí hiếm;
B. mở đầu chu kì là một phi kim điển hình, cuối chu kì là một kim loại điển hình và kết thúc chu kì là một khí hiếm;
C. mở đầu chu kì là một khí hiếm (trừ chu kì 1), cuối chu kì là một phi kim điển hình và kết thúc chu kì là một kim loại điển hình;
D. mở đầu chu kì là một phi kim điển hình, cuối chu kì là một khí hiếm và kết thúc chu kì là một kim loại điển hình.
Đáp án: A
Giải thích:
Trong một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân: mở đầu chu kì là một kim loại điển hình (trừ chu kì 1), cuối chu kì là một phi kim điển hình và kết thúc chu kì là một khí hiếm.
Câu 7. Khẳng định sai là
A. Các nguyên tố hóa học được chia thành 3 loại: kim loại, phi kim và khí hiếm;
B. Các nguyên tố nhóm IA, IIA và IIIA là kim loại (trừ hydrogen và boron);
C. Các nguyên tố ở nhóm VA, VIA là phi kim;
D. Các nguyên tố ở nhóm VIIIA là khí hiếm.
Đáp án: C
Giải thích:
Trong các nhóm VA, VIA ở phía cuối nhóm vẫn có các nguyên tố kim loại.
Vì vậy, ta chỉ khẳng định: Hầu hết các nguyên tố ở nhóm VA, VIA là phi kim.
Do đó, khẳng định C sai.
Câu 8. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn là
A. Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử;
B. Các nguyên tố được xếp trong cùng một hàng có cùng số lớp electron trong nguyên tử;
C. Các nguyên tố trong cùng một cột có tính chất hóa học tương tự nhau;
D. Cả A, B và C.
Đáp án: D
Giải thích:
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn là:
- Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử;
- Các nguyên tố được xếp trong cùng một hàng có cùng số lớp electron trong nguyên tử;
- Các nguyên tố trong cùng một cột có tính chất hóa học tương tự nhau;
Câu 9. Cấu tạo bảng tuần hoàn gồm
A. Ô nguyên tố;
B. Chu kì;
C. Nhóm;
D. Cả A, B và C.
Đáp án: D
Giải thích:
Cấu tạo bảng tuần hoàn gồm:
- Ô nguyên tố;
- Chu kì;
- Nhóm;
Câu 10. Cho nguyên tố Y có số hiệu nguyên tử là 18. Dựa vào bảng tuần hoàn hãy xác định thông tin nào dưới đây sai?
A. Y có tên là argon, kí hiệu hóa học là Ar;
B. Y ở ô thứ 18, chu kì 3;
C. Y ở nhóm VIIIA;
D. Y là một phi kim điển hình.
Đáp án: D
Giải thích:
Thông tin sai là D.
Vì Y ở nhóm VIIIA mà nhóm VIIIA là nhóm các nguyên tố khí hiếm. Do đó Y là một nguyên tố khí hiếm.
Video giải KHTN 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học - Cánh diều
Phần II. Lý thuyết KHTN 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
I. Nguyên tắc sắp xếp bảng tuần hoàn các nguyên tố hóa học
- Các nguyên tố hóa học được xếp theo quy luật trong một bảng, gọi là bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn).
- Bảng tuần hoàn hiện nay có 118 nguyên tố hóa học và được xếp theo nguyên tắc sau:
+ Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố được xếp trong cùng một hàng có cùng số lớp electron trong nguyên tử.
+ Các nguyên tố trong cùng một cột có tính chất hóa học tương tự nhau.
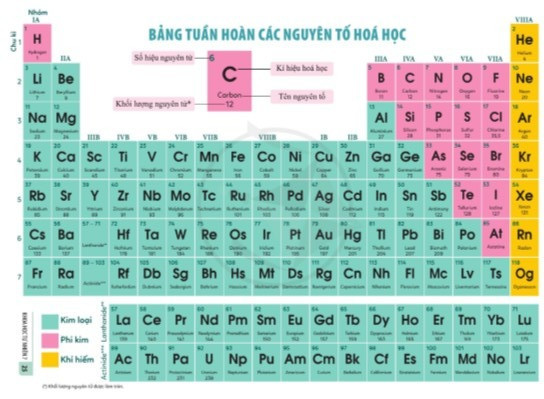
II. Cấu tạo bảng tuần hoàn
Bảng tuần hoàn gồm các ô được sắp xếp thành các hàng và các cột.
1. Ô nguyên tố
- Ô nguyên tố: là một ô trong bảng tuần hoàn tương ứng với một nguyên tố hóa học.
- Ô nguyên tố cho biết:
+ Số hiệu nguyên tử (kí hiệu là Z): bằng số đơn vị điện tích hạt nhân (bằng số proton và bằng số electron) và là số thứ tự của nguyên tố
+ Kí hiệu hóa học
+ Tên nguyên tố
+ Khối lượng nguyên tử
Ví dụ: Ô nguyên tố oxygen
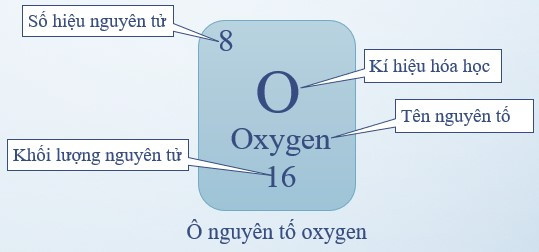
2. Chu kì
- Chu kì gồm các nguyên tố thuộc cùng nguyên tử có cùng số lớp electron và được sắp xếp thành hàng theo chiều tăng dần của điện tích hạt nhân.
- Số thứ tự của chu kì = số lớp electron của nguyên tố
- Bảng tuần hoàn hiện nay gồm 7 chu kì, được đánh số từ chu kì 1 đến chu kì 7.
- Trong một chu kì, khi đi từ trái qua phải theo chiều tăng dần của điện tích hạt nhân:
+ Mở đầu chu kì là một kim loại điển hình (trừ chu kì 1).
+ Cuối chu kì là một phi kim điển hình (trừ chu kì 7).
+ Kết thúc chu kì là một khí hiếm.
- Ví dụ: Trong chu kì 4:
+ Mở đầu chu kì là nguyên tố potassium (K) – là một kim loại điển hình
+ Cuối chu kì là nguyên tố bromine (Br) – là một phi kim điển hình
+ Kết thúc chu kì là nguyên tố krypton (Kr) – là một khí hiếm
3. Nhóm
- Nhóm gồm các nguyên tố có tính chất hóa học tương tự nhau, được xếp thành cột theo chiều tăng dần của điện tích hạt nhân.
- Bảng tuần hoàn gồm 18 cột gồm:
+ 8 cột là nhóm A.
+ 10 cột là nhóm B: gọi kà nhóm các nguyên tố kim loại chuyển tiếp (trong phạm vi chương trình chỉ nghiên cứu 8 nhóm A).
- Nhóm A được đánh số bằng số La Mã lần lượt từ nhóm IA đến VIIIA.
- Số thứ tự của nhóm A = số electron lớp ngoài cùng.
Ví dụ:
+ Nhóm IA: gồm các nguyên tố kim loại hoạt động mạnh (kim loại điển hình), trừ hydrogen (H); đều có 1 electron ở lớp ngoài cùng.
+ Nhóm VIIA: gồm các nguyên tố phi kim hoạt động mạnh (phi kim điển hình), trừ tennessine (Ts); đều có 7 electron ở lớp ngoài cùng.
III. Vị trí của các nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
- Các nguyên tố kim loại: (chiếm hơn 80% trong bảng tuần hoàn), nằm bên góc trái và góc dưới bên phải của bảng tuần hoàn.
- Các nguyên tố phi kim: nằm phía trên, bên phải của bảng tuần hoàn. Trong đó, các phi kim hoạt động mạnh nằm ở phía trên.
- Các nguyên tố khí hiếm: Là nguyên tố nằm trong nhóm VIIIA.
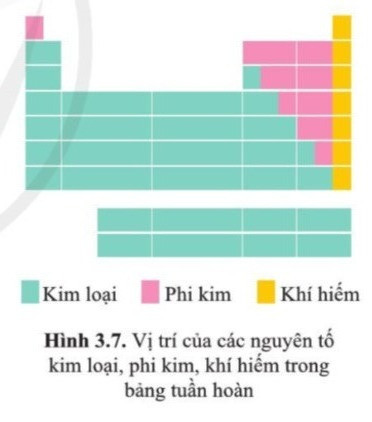
IV. Ý nghĩa của bảng tuần hoàn
Bảng tuần hoàn cho biết:
- Các thông tin của một nguyên tố hóa học: tên nguyên tố, số hiệu nguyên tử, kí hiệu hóa học, khối lượng nguyên tử.
- Vị trí của nguyên tố hóa học (ô, chu kì, nhóm). Từ đó nhận ra được các nguyên tố kim loại, phi kim hay khí hiếm:
+ Các nguyên tố ở nhóm IA, IIA, IIIA là kim loại (trừ hydrogen và boron).
+ Hầu hết các nguyên tố ở nhóm VA, VIA, VIIA là phi kim.
+ Các nguyên tố nhóm VIIIA là khí hiếm.
Ví dụ: Bảng tuần hoàn cho biết nguyên tố bromine (Br) ở ô số 35, chu kì 4, nhóm VIIA, là nguyên tố phi kim.