Lý thuyết Ảnh hưởng của liên kết hydrogen và tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi các chất
1. Liên kết hydrogen
a) Khái niệm
Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
Liên kết hydrogen thường được kí hiệu là dấu ba chấm (…), rải đều từ nguyên tử H đến nguyên tử tạo liên kết hydrogen với nó.
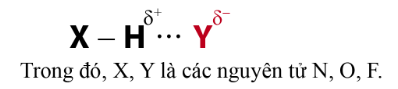
Chú ý: Liên kết hydrogen có bản chất tĩnh điện. Tương tác hút tĩnh điện giữa H+d và Y-d thể hiện bản chất của liên kết hydrogen.
Ví dụ:

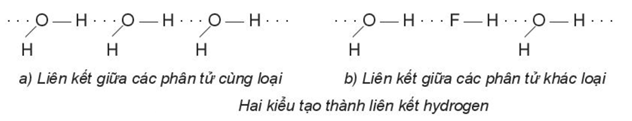
b) Điều kiện cần và đủ để tạo thành liên kết hydrogen
+ Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N, …
+ Nguyên tử F, O, N, … liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết.
Một số kiểu tạo thành liên kết hydrogen:
2. Tương tác van der Waals
Tương tác van der Waals là một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử.
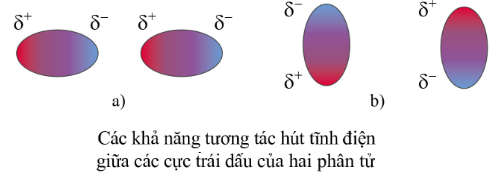
Ví dụ: Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng. Như vậy, ở nhiệt độ thấp, giữa các nguyên tử khí hiếm tồn tại một tương tác yếu để giữ các nguyên tử khí hiếm lại với nhau trong trạng thái lỏng. Tương tác đó cũng là tương tác van der Waals.
Chú ý: Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
3. Ảnh hưởng của liên kết hydrogen và tương tác van der Waals đến nhiệt độ nóng chảy và nhiệt độ sôi các chất
Liên kết hydrogen và tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Trong đó, liên kết hydrogen có ảnh hưởng mạnh hơn.
Ví dụ 1: Giải thích vì sao nhiệt độ nóng chảy và nhiệt độ sôi của H2O cao hơn nhiều so với H2S và CH4?
Hướng dẫn giải
Lực hút tĩnh điện giữa nguyên tử H mang một phần điện tích dương (linh động) của phân tử H2O này với nguyên tử oxygen mang một phần điện tích âm của phân tử H2O khác, tạo thành liên kết yếu giữa các phân tử nước, gọi là liên kết hydrogen:
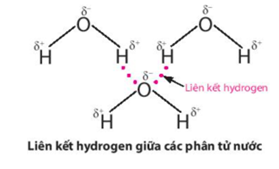
Do ảnh hưởng của liên kết hydrogen nên nhiệt độ nóng chảy và nhiệt độ sôi của H2O cao hơn nhiều so với H2S và CH4 (không có liên kết hydrogen).
Thực tế, nhiệt độ nóng chảy và nhiệt độ sôi các chất này như sau:
|
|
H2O |
H2S |
CH4 |
|
Nhiệt độ nóng chảy (oC) |
0 |
-85,6 |
-182,5 |
|
Nhiệt độ sôi (oC) |
100 |
-60,75 |
-161,58 |
Ví dụ 2: Giải thích xu hướng biến đổi nhiệt độ nóng chảy và nhiệt độ sôi của các nguyên tố khí hiếm (nhóm VIIIA) trong bảng dưới đây.
|
Khí hiếm |
He |
Ne |
Ar |
Xn |
Kr |
Rn |
|
Nhiệt độ nóng chảy |
-272oC |
-247oC |
-189oC |
-157oC |
-119oC |
-71oC |
|
Nhiệt độ sôi |
-269oC |
-246oC |
-186oC |
-152oC |
-108oC |
-62oC |
Hướng dẫn giải
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
Vậy:
Trong nhóm VIIIA, theo chiều tăng dần của điện tích hạt nhân (từ He đến Rn), khối lượng nguyên tử tăng ® Tương tác van der Waals tăng ® Nhiệt độ nóng chảy và nhiệt độ sôi tăng.
Ví dụ 3: Pentane là hydrocarbon no có công thức C5H12. Giải thích vì sao đồng phân mạch không phân nhánh pentane có nhiệt độ sôi (36oC) cao hơn so với đồng phân mạch nhánh neopentane (9,5oC).
Hướng dẫn giải
Pentane là hydrocarbon no có công thức C5H12. Đồng phân mạch không phân nhánh pentane có nhiệt độ sôi (36oC) cao hơn so với đồng phân mạch nhánh neopentane (9,5oC) do diện tích tiếp xúc giữa các phân tử pentane lớn hơn nhiều so với neopentane.
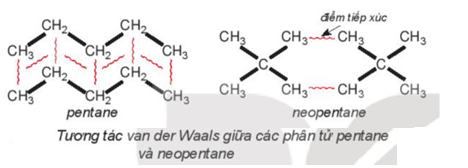
® Để phá vỡ lực liên kết phân tử giữa các phân tử pentane cần nhiều năng lượng hơn so với neopentane, nên nhiệt độ sôi cao hơn.