Lý thuyết Vận dụng quy tắc octet xác định hướng của nguyên tử khi tham gia liên kết
1. Quy tắc octet:
- Nội dung: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của khí hiếm.
- Ứng dụng: Quy tắc octet lần đầu được đưa ra bởi Lewis để lí giải xu hướng các nguyên tử trở lên bền vững hơn trong phản ứng hóa học. Cụ thể:
+ Các nguyên tử nguyên tố khí hiếm bền vững hơn rất nhiều so với các nguyên tử nguyên tố khác trong cùng chu kỳ nên rất khó tham gia phản ứng hóa học. Điều này là do chúng đã có lớp electron bão hòa với 8 electron (ngoại lệ là helium với 2 electron lớp ngoài cùng).
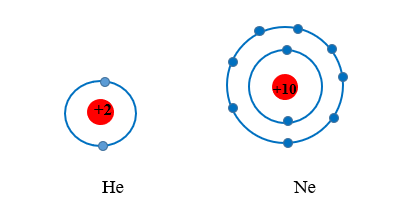
+ Các nguyên tử liên kết với nhau theo xu hướng chung là tạo ra lớp electron ngoài cùng như của khí hiếm gần nhất để mỗi nguyên tử đó trở nên bền vững hơn.
2. Vận dụng quy tắc octet xác định hướng của nguyên tử tham gia liên kết
- Trong quá trình hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình electron bền vững của khí hiếm.
+ Các nguyên tử kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng nhường bớt toàn bộ các electron này để tạo thành các ion dương tương ứng với 8 electron ở lớp ngoài cùng (trừ Li). Ví dụ:
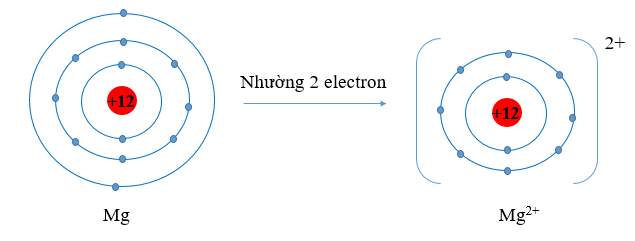
Viết gọn: Mg → Mg2+ + 2e
+ Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng nhận thêm electron để tạo thành ion với 8 electron ở lớp ngoài cùng. Ví dụ:
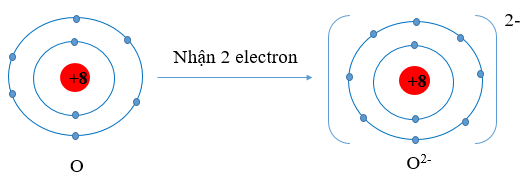
Viết gọn: O + 2e → O2-
Ngoài ra, các phi kim có thể góp chung electron để đạt được octet.
Chú ý:
Quy tắc octet có một số ngoại lệ như: SF6 (lớp vỏ ngoài cùng của S có 12 electron); PCl5 (lớp vỏ ngoài cùng của P có 10 electron); …
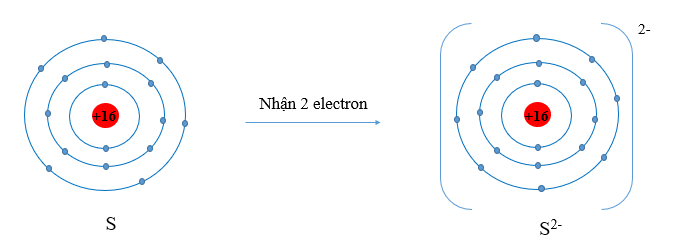
Ví dụ 1: Sulfur có Z = 16, cho biết xu hướng cơ bản của nguyên tử sulfur khi hình thành liên kết hóa học. Hãy viết sơ đồ minh họa quá trình đó.
Hướng dẫn:
Nguyên tử sulfur có cấu hình electron: [Ne]3s23p4, có 6 electron ở lớp ngoài cùng.
Vậy xu hướng cơ bản của nguyên tử sulfur khi hình thành liên kết hóa học là nhận thêm 2 electron để đạt 8 electron lớp ngoài cùng như khí hiếm Ar.
Sơ đồ minh họa:
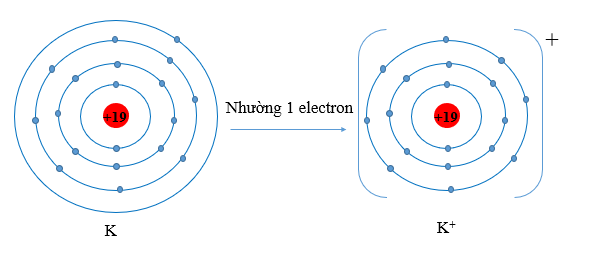
Ví dụ 2: Hãy dự đoán xu hướng nhường, nhận electron của potassium (Z = 19). Vẽ sơ đồ quá trình nguyên tử nhường, nhận electron để tạo ra ion.
Hướng dẫn:
Nguyên tử potassium với cấu hình electron là [Ar]4s1, có 1 electron ở lớp ngoài cùng.
Vậy xu hướng của nguyên tử potassium khi hình thành liên kết hóa học là nhường đi 1 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài cùng như khí hiếm Ar.
Sơ đồ minh họa:
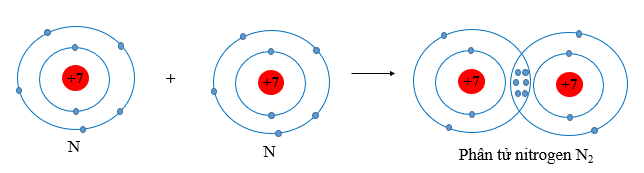
Ví dụ 3: Vận dụng quy tắc octet giải thích sự hình thành liên kết trong phân tử N2.
Biết N (Z = 7), phân tử N2 được hình thành bởi sự góp chung electron.
Hướng dẫn:
Cấu hình electron nguyên tử N: [He]2s22p3, mỗi nguyên tử N có 5 electron ở lớp ngoài cùng.
Khi hình thành phân tử N2, mỗi nguyên tử N cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử N góp chung 3 electron.
Sơ đồ minh họa: