Lý thuyết Bài tập về định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
1. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
2. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Khi biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra cấu tạo nguyên tử của nguyên tố đó và ngược lại. Từ đó, có thể suy ra những tính chất hóa học cơ bản của nó.

- Mối quan hệ giữa cấu hình electron và vị trí nguyên tố trong bảng tuần hoàn:
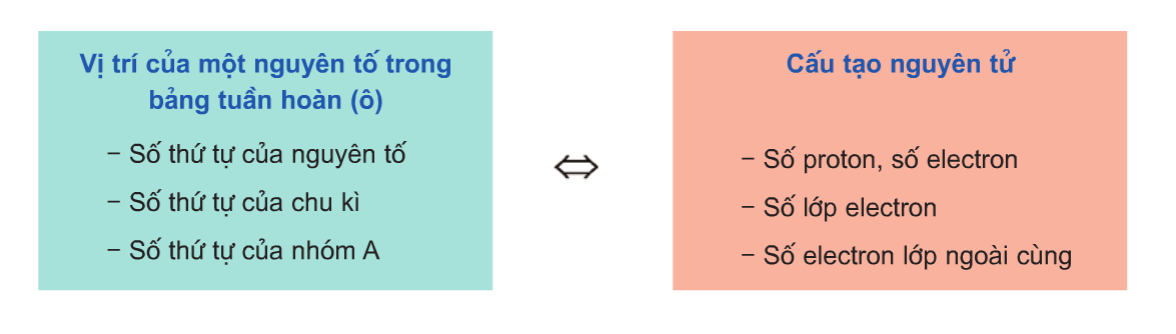
- Mối quan hệ giữa cấu hình electron nguyên tử và tính chất nguyên tố:
+ Các nguyên tử có 1, 2 hoặc 3 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố kim loại (trừ H, He, B).
+ Các nguyên tử có 5, 6 hoặc 7 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố phi kim.
+ Các nguyên tử có 8 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố khí hiếm (trừ He chỉ có 2 electron).
+ Nếu lớp electron ngoài cùng có 4 electron thì nguyên tử nguyên tố có thể là kim loại hoặc phi kim.
Ví dụ 1: Nguyên tố sulfur (S) ở ô số 16, chu kì 3, nhóm VIA của bảng tuần hoàn.
a) Viết cấu hình electron nguyên tử của sulfur.
b) Nêu một số tính chất cơ bản của đơn chất và oxide, hydroxide chứa sulfur.
Hướng dẫn giải
a)
Số proton = Số electron = Số hiệu nguyên tử Z = Số thứ tự ô = 16
Số lớp electron = Số thứ tự chu kì = 3
Số electron lớp ngoài cùng = Số thứ tự nhóm A = 6
® Cấu hình electron của S (Z = 16): 1s22s22p63s23p4 hay [Ne]3s23p4.
b)
Nguyên tử S có 6 electron ở lớp ngoài cùng.
® S là nguyên tố phi kim.
Nguyên tố S thuộc nhóm VIA ® Hóa trị cao nhất của S là VI.
® Oxide cao nhất SO3 là acidic oxide và acid tương ứng H2SO4 là acid mạnh.
Ví dụ 2: Potassium (Z = 19) là nguyên tố dinh dưỡng thiết yếu cho thực vật và con người.
a) Nêu vị trí của potassium trong bảng tuần hoàn.
b) Nếu một số tính chất cơ bản của đơn chất và oxide cao nhất, hydroxide chứa potassium.
Hướng dẫn giải
a) Cấu hình electron nguyên tử của K (Z = 19): 1s22s22p63s23p64s1 hay [Ar]4s1.
Số thứ tự ô = Số hiệu nguyên tử Z = 19.
Số thứ tự chu kì = Số lớp electron = 4.
Cấu hình electron lớp ngoài cùng là 4s1 ® K thuộc nhóm A.
Số thứ tự nhóm A = Số electron lớp ngoài cùng = 1 ® K thuộc nhóm IA.
Vậy, nguyên tố potassium thuộc ô 19, chu kì 4, nhóm IA trong bảng tuần hoàn.
b)
Số electron lớp ngoài cùng là 1 ® K là nguyên tố kim loại.
K thuộc nhóm IA ® Hóa trị cao nhất của K là I.
Công thức oxide cao nhất K2O là basic oxide và base tương ứng KOH là base mạnh.
Ví dụ 3: So sánh tính phi kim của P (Z = 15), O (Z = 8) và S (Z = 16).
Hướng dẫn giải
P (Z = 15): 1s22s22p63s23p3 ® Nguyên tố P thuộc chu kì 3, nhóm VA.
O (Z = 8): 1s22s22p4 ® Nguyên tố O thuộc chu kì 2, nhóm VIA.
S (Z = 16): 1s22s22p63s23p4 ® Nguyên tố S thuộc chu kì 3, nhóm VIA.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần ® Tính phi kim: P < S.
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần ® Tính phi kim: S < O.
Vậy tính phi kim: P < S < O.