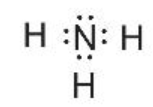Lý thuyết Giải thích sự tạo thành liên kết cộng hóa trị. Viết công thức Lewis
1. Liên kết cộng hóa trị
a) Khái niệm
Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
Cặp electron dùng chung giữa hai nguyên tử có thể được tạo thành theo hai kiểu khác nhau:
- Mỗi nguyên tử góp một hay nhiều electron để tạo thành các cặp electron dùng chung:
Ví dụ:
Liên kết giữa H và Cl còn được biểu diễn bằng 1 gạch nối “ – ”
- Cặp electron dùng chung chỉ do một nguyên tử đóng góp, liên kết giữa hai nguyên tử là liên kết cộng hóa trị kiểu cho – nhận.
Ví dụ: Khi cặp electron dùng chung chỉ do nguyên tử B đóng góp, nguyên tử B là nguyên tử cho electron, nguyên tử A là nguyên tử nhận electron. Kí hiệu B ® A.
Nhận xét:
+ Liên kết do sự dùng chung cặp electron là loại liên kết rất phổ biến, thường gặp giữa phi kim với phi kim.
+ Nguyên tử phi kim có xu hướng nhận thêm electron để đạt cấu hình electron bền vững của khí hiếm. Khi hai nguyên tử phi kim kết hợp với nhau tạo thành phân tử, chúng sẽ góp chung một hoặc nhiều electron để tạo thành các cặp electron dùng chung. Các cặp electron dùng chung được tính cho cả hai nguyên tử trong phân tử nên mỗi nguyên tử đều đạt cấu hình bền vững theo quy tắc octet. Cặp electron dùng chung tạo ra liên kết cộng hóa trị giữa hai nguyên tử.
b) Sự tạo thành liên kết cộng hóa trị
- Cách viết công thức Lewis
Công thức Lewis biểu diễn sự hình thành liên kết hóa học giữa các nguyên tử trong một phân tử. Công thức Lewis của một phân tử được xây dựng từ công thức electron của phân tử, trong đó mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng một gạch nối “ – ”.
- Sự tạo thành phân tử có liên kết đơn
Ví dụ: Sự hình thành liên kết trong phân tử chlorine (Cl2).
Cấu hình electron của nguyên tử Cl (Z = 17): [Ne]3s23p5 (có 7 ở lớp ngoài cùng).
Để đạt cấu hình của khí hiếm gần nhất, nguyên tử Cl cần thêm 1 electron. Vì vậy, hai nguyên tử chlorine liên kết với nhau bằng cách mỗi nguyên tử chlorine góp 1 electron, tạo thành 1 cặp electron dùng chung. Khi đó, trong phân tử Cl2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet:
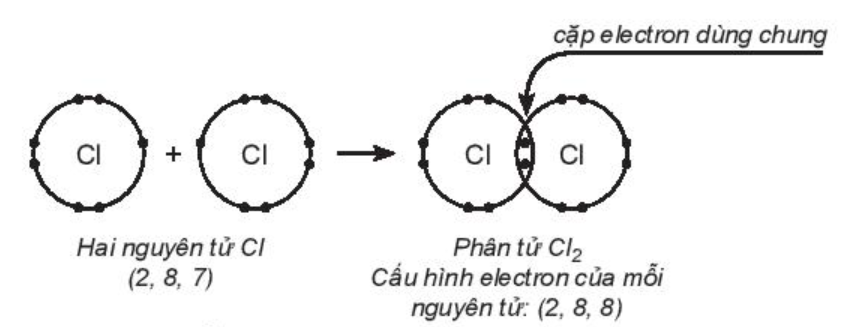
Từ công thức electron, thay một cặp electron dùng chung bằng một gạch nối thì thu được công thức Lewis:

Chú ý:
Giữa hai nguyên tử chlorine có một cặp electron dùng chung (biểu diễn bằng một gạch nối), đó là liên kết đơn (–).
- Sự tạo thành phân tử có liên kết đôi
Ví dụ: Sự hình thành liên kết trong phân tử oxygen (O2).
Cấu hình electron của nguyên tử O (Z = 8): 1s22s22p4 (có 6 electron ở lớp ngoài cùng).
Mỗi nguyên tử oxygen có 6 electron hóa trị, hai nguyên tử oxygen liên kết với nhau bằng cách mỗi nguyên tử đóng góp 2 electron, tạo thành 2 cặp electron dùng chung. Trong phân tử O2, mỗi nguyên tử oxygen đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
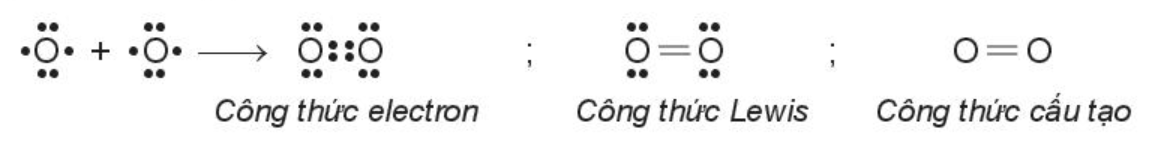
Chú ý: Giữa hai nguyên tử oxygen có hai cặp electron dùng chung (biểu diễn bằng hai gạch nối), đó là liên kết đôi (=).
- Sự tạo thành phân tử có liên kết ba
Ví dụ: Sự hình thành liên kết trong phân tử nitrogen (N2).
Cấu hình electron của nguyên tử N (Z = 7): 1s22s22p3 (có 5 electron ở lớp ngoài cùng).
Nguyên tử nitrogen có 5 electron hóa trị, hai nguyên tử nitrogen liên kết với nhau bằng cách mỗi nguyên tử nitrogen đóng góp 3 electron, tạo thành 3 cặp electron dùng chung. Khi đó, trong phân tử N2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.

Chú ý: Giữa hai nguyên tử nitrogen có ba cặp electron dùng chung (biểu diễn bằng ba gạch nối), đó là liên kết ba (º).
Nhận xét:
Liên kết cộng hóa trị trong đó cặp electron dùng chung không bị hút lệch về phía nguyên tử nào được gọi là liên kết cộng hóa trị không phân cực. Ví dụ: Cl2, N2.
Liên kết cộng hóa trị trong đó cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn được gọi là liên kết cộng hóa trị phân cực. Ví dụ: HCl (cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn là Cl).
2. Liên kết cho – nhận
Liên kết cho – nhận là liên kết mà cặp electron chung được đóng góp từ một nguyên tử.
Ví dụ: Phân tử ammonia kết hợp với ion H+ tạo ra cation ammonium (NH4+)
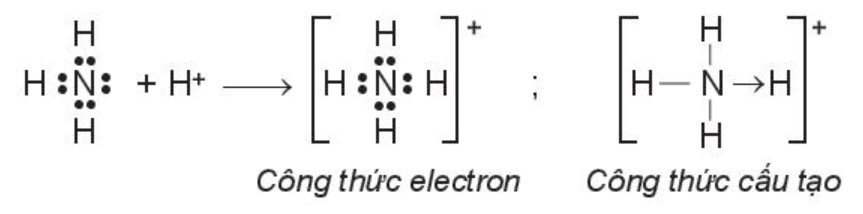
Trong phân tử NH3, lớp ngoài cùng của nguyên tử nitrogen có 5 electron, trong đó có cặp electron chưa liên kết. Ion H+ có orbital trống, không có electron. Khi phân tử NH3 kết hợp với ion H+, nguyên tử nitrogen đóng góp cặp electron chưa liên kết để tạo liên kết với ion H+ tạo thành NH+4. Khi đó, liên kết cho – nhận được hình thành, nguyên tử nitrogen là nguyên tử cho, ion H+ là nguyên tử nhận.Trong ion NH+4, bốn liên kết N – H hoàn toàn tương đương nhau.
Để chỉ rõ sự khác biệt về nguồn gốc cặp electron chung, liên kết tạo bởi cặp electron của N và ion H+ được kí hiệu là mũi tên (®) xuất phát từ N. Loại liên kết này được gọi là liên kết cho – nhận.
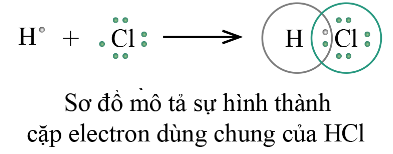
Ví dụ 1: Trình bày sự hình thành liên kết cộng hóa trị trong phân tử hydrogen chloride (HCl).
Hướng dẫn giải
Nguyên tử hydrogen (H) có cấu hình electron 1s1, chlorine (Cl) có cấu hình electron [Ne]3s23p5.
Nguyên tử hydrogen liên kết với nguyên tử chlorine bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl. Khi đó nguyên tử hydrogen có 2 electron (cấu hình bền vững của nguyên tử khí hiếm helium) và nguyên tử chlorine có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.

Nhận xét: Liên kết trong phân tử HCl có cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn (Cl) được gọi là liên kết cộng hóa trị phân cực.
Ví dụ 2: Trình bày sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide (CO2).
Hướng dẫn giải
Cấu hình electron của nguyên tử C (Z = 6): 1s22s22p2 (có 4 electron hóa trị).
Cấu hình electron của nguyên tử O (Z = 8): 1s22s22p4 (có 6 electron hóa trị).
® Hai nguyên tử oxygen liên kết với một nguyên tử carbon bằng cách mỗi nguyên tử oxygen đóng góp 2 electron và nguyên tử carbon đóng góp 4 electron tạo thành 4 cặp electron dùng chung. Khi đó, trong phân tử CO2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.

Nhận xét:
Phân tử CO2 có hai liên kết đôi.
Liên kết giữa C và O là liên kết cộng hóa trị phân cực. Tuy nhiên, do phân tử CO2 có cấu tạo thẳng nên độ phân cực của hai liên kết (C=O) triệt tiêu nhau, dẫn đến toàn bộ phân tử không bị phân cực.
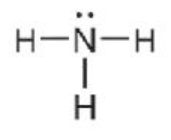
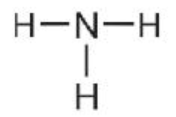
Ví dụ 3: Viết công thức electron, công thức cấu tạo và công thức Lewis của phân tử NH3.
Hướng dẫn giải
Cấu hình electron của nguyên tử N (Z = 7): 1s22s22p3.
Cấu hình electron của nguyên tử H (Z = 1): 1s1.
® Ba nguyên tử H liên kết với một nguyên tử N bằng cách mỗi nguyên tử H đóng góp 1 electron và nguyên tử N đóng góp 3 electron tạo thành 3 cặp electron dùng chung. Khi đó, trong phân tử NH3, mỗi nguyên tử H có 2 electron (cấu hình bền vững của nguyên tử khí hiếm helium) và nguyên tử N có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
|
|
|
|
|
Công thức electron |
Công thức Lewis |
Công thức cấu tạo |