Lý thuyết Bài tập về sự hình thành liên kết sigma, liên kết pi
Liên kết cộng hóa trị được hình thành khi các orbital nguyên tử của hai nguyên tố xen phủ lẫn nhau. Sự xen phủ này có thể xảy ra theo hai cách là xen phủ trục và xen phủ bên, hình thành nên hai loại liên kết cộng hóa trị tương ứng là liên kết sigma (s) và liên kết pi (p).
Chú ý: Liên kết cộng hóa trị được hình thành từ cặp electron dùng chung. Để tạo nên một cặp electron chung, hai AO chứa electron độc thân (hoặc giữa 1 AO trống và 1 AO bão hòa electron) cần xen phủ với nhau.
1. Sự hình thành liên kết sigma (s)
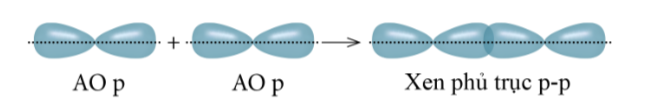
Liên kết sigma (s) là loại liên kết cộng hóa trị được hình thành do sự xen phủ trục của hai orbital. Vùng xen phủ trục nằm trên đường nối tâm hai nguyên tử.
Phần tài liệu này chỉ xét đến sự xen phủ của AO s và AO p.
Xen phủ trục là xen phủ giữa hai AO dọc theo trục nối (trục z) của hai nguyên tử. Có ba khả năng xen phủ trục:
- Xen phủ giữa AO s với AO s:

- Xen phủ giữa AO s với AO p:
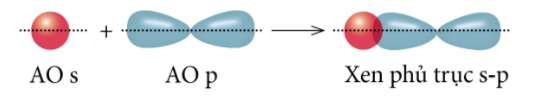
- Xen phủ giữa AO p với AO p:
2. Sự hình thành liên kết pi (p)
Sự xen phủ, trong đó trục của các orbital tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết, được gọi là xen phủ bên. Sự xen phủ bên tạo ra liên kết p (pi).
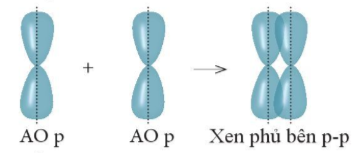
Liên kết pi (p) là loại liên kết cộng hóa trị được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ nằm hai bên đường nối tâm hai nguyên tử.
Nhận xét:
Các liên kết cộng hóa trị đơn đều là liên kết s. Trong liên kết s, mật độ xác suất tìm thấy electron lớn nhất dọc theo trục liên kết.
Liên kết đôi gồm một liên kết s và một liên kết p. Liên kết ba gồm một liên kết s và hai liên kết p.
Liên kết s bền vững hơn liên kết p bởi vùng xen phủ AO chứa electron chung chắn giữa hai hạt nhân, làm giảm lực đẩy giữa chúng. Để phân tử bền vững thì trong phân tử phải luôn có liên kết s.
Ví dụ 1: Mô tả sự tạo thành liên kết bằng sự xen phủ các orbital nguyên tử trong
a) phân tử hydrogen (H2).
b) phân tử fluorine (F2).
Hướng dẫn giải
a) Phân tử hydrogen (H2).
Cấu hình electron của nguyên tử H (Z = 1): 1s1.
Cấu hình electron theo ô orbital của H: 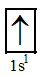 .
.
® AO 1s của hai nguyên tử H xen phủ với nhau theo trục liên kết, hình thành liên kết s trong phân tử H2.
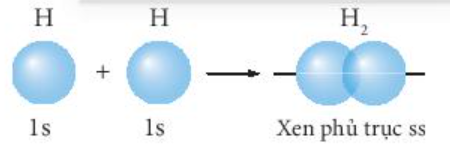
b) Phân tử fluorine (F2).
Cấu hình electron theo orbital của F (Z = 9): ![]() .
.
® AO 2p (còn electron độc thân) của hai nguyên tử F xen phủ với nhau theo trục liên kết (trục z), hình thành liên kết s trong phân tử F2.
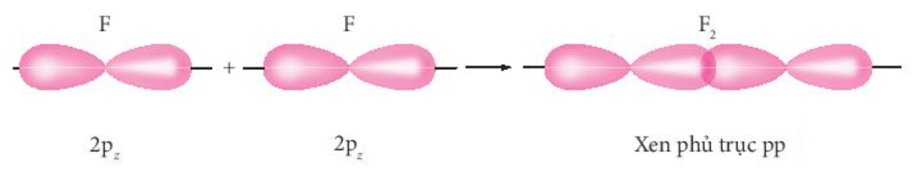
Ví dụ 2: Mô tả sự tạo thành liên kết bằng sự xen phủ các orbital nguyên tử trong phân tử hydrogen fluoride (HF).
Hướng dẫn giải
Cấu hình electron theo orbital của H (Z = 1): 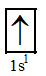
Cấu hình electron theo orbital của F (Z = 9): ![]()
® AO 1s của nguyên tử hydrogen (H) xen phủ với AO 2p (orbital còn electron độc thân) của nguyên tử fluorine (F) hình thành liên kết s trong phân tử hydrogen fluoride (HF).
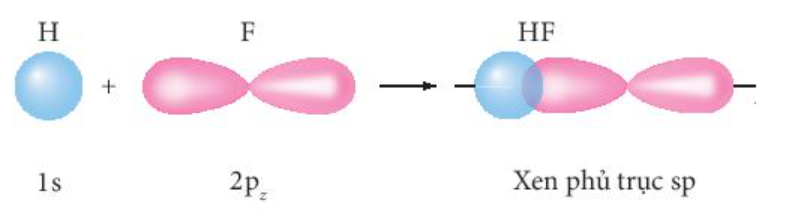
Ví dụ 3: Mô tả sự tạo thành liên kết bằng sự xen phủ các orbital nguyên tử trong phân tử oxygen (O2).
Hướng dẫn giải
Cấu hình electron theo orbital của O (Z = 8): ![]() .
.
Vậy:
Mỗi nguyên tử O dùng một AO 2pz (quy ước lấy trục z làm trục liên kết) để tạo liên kết giữa hai nguyên tử theo kiểu xen phủ trục tạo liên kết s.
Mỗi nguyên tử O dùng một AO 2py để tạo liên kết giữa hai nguyên tử theo kiểu xen phủ bên tạo liên kết p.
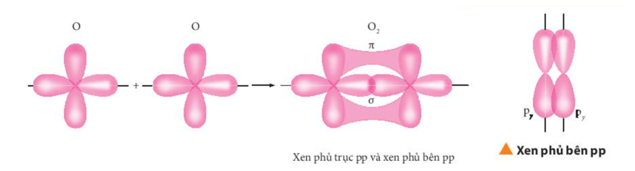
Công thức cấu tạo của O2: O=O (liên kết đôi: gồm một liên kết s và một liên kết p).