Lý thuyết Tính khối lượng, kích thước nguyên tử, hạt nhân
1. Khối lượng và điện tích các hạt cơ bản cấu tạo nên nguyên tử:
|
|
Vỏ nguyên tử |
Hạt nhân |
|
|
Loại hạt |
electron |
proton |
neutron |
|
Kí hiệu |
e |
p |
n |
|
Điện tích tương đối |
-1 |
+1 |
0 |
|
Điện tích Coulomb (C) |
-1,602.10-19 |
+1,602.10-19 |
0 |
|
Khối lượng (kg) |
9,109.10-31 |
1,673.10-27 |
1,675.10-27 |
|
Khối lượng (amu) amu = atomic mass unit |
0,00055 |
1 |
1 |
2. Khối lượng của nguyên tử
- Khối lượng của nguyên tử vô cùng nhỏ.
- Khối lượng nguyên tử thường được biểu thị theo đơn vị amu.
- Nguyên tử có khối lượng nhỏ nhất là nguyên tử của nguyên tố hydrogen (H), có khối lượng là 1 amu.
- Nguyên tử có khối lượng lớn nhất là nguyên tử của nguyên tố uranium (U), có khối lượng là 238 amu.
- Do khối lượng của các electron (0,00055 amu) rất nhỏ so với khối lượng của proton (1 amu) hay neutron (1 amu) nên khối lượng nguyên tử tập trung chủ yếu ở hạt nhân nguyên tử. Một cách gần đúng, có thể coi khối lượng của nguyên tử bằng khối lượng của hạt nhân.
3. Kích thước của nguyên tử
- Kích thước của nguyên tử là vô cùng nhỏ.
- Coi nguyên tử có dạng hình cầu, khi đó, đường kính của nó chỉ khoảng 10-10 m
- Nguyên tử có đường kính nhỏ nhất là helium (0,62 ), nguyên tử có đường kính lớn nhất là francium (7,0)
Chú ý: Angstrom là đơn vị đo độ dài, kí hiệu là
1 = 102 pm = 10-10 m = 10-8 cm
1nm = 10-9 m = 10-7 cm
- Hạt nhân nguyên tử có kích thước rất nhỏ so với nguyên tử. Kích thước hạt nhân bằng khoảng 10-5 đến 10-4 lần kích thước nguyên tử. Đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10 000 lần.
Như vậy, phần không gian rỗng chiếm chủ yếu trong nguyên tử ⇒ nguyên tử có cấu trúc rỗng.
Cách 1: Xây dựng công thức tính bán kính nguyên tử kim loại
(a) Khối lượng riêng:
(b) Công thức tính V hình cầu V(cầu) =
(c) 1 mol nguyên tử có chứa số nguyên tử là A = 6,023.1023 (số Avogadro)
(d) Coi nguyên tử là hình cầu, rỗng, độ đặc khít (hay mức độ chiếm trong tinh thể đạt b%)
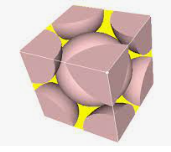
Xây dựng
- Lấy 1 mol kim loại tương đương NA nguyên tử kim loại (NA = 6,023.1023); Nặng tương ứng M gam.
- Do D (nguyên tử ) vậy thể tích của 1 mol nguyên tử =
Do thực tế chỉ chiếm b% nên thể tích 1 mol nguyên tử đạt =
Vậy thể tích 1 nguyên tử là
Mặt khác 1 nguyên tử có thể tích là V1 nguyên tử = (với r là bán kính nguyên tử)
Vậy V1 nguyên tử = từ đó rút ra
Cách thứ 2: Coi nguyên tử có dạng hình cầu, bán kính nguyên tử được tính theo công thức sau:
Ví dụ 1. Khối lượng của nguyên tử magnesium là 39,8271.10-27 kg. Khối lượng của magnesium theo amu là
Hướng dẫn giải:
1 amu = 1,661.10-27 kg
Khối lượng của magnesium theo amu là:
Ví dụ 2: Nguyên tử helium có 2 proton, 2 neutron và 2 electron. Khối lượng của các electron chiếm bao nhiêu % khối lượng nguyên tử helium?
Hướng dẫn giải:
Cách 1:
Ta có: me = 0,00055u; mn ≈ mp ≈ 1amu.
Vậy %me = \[\frac{{0,00055.2}}{{2 + 2 + 0,00055.2}}.100\% \approx 0,027\% .\]
Cách 2:
Ta có: me = 9,109.10-31 kg; mn = 1,675.10-27 kg; mp = 1,673.10-27 kg.
Vậy %me = \[\frac{{9,{{1.10}^{ - 31}}.2}}{{1,{{673.10}^{ - 27}}.2 + 1,{{675.10}^{ - 27}}.2 + 9,{{109.10}^{ - 31}}.2}}.100\% \approx 0,0272\% .\]
Ví dụ 3: Bán kính nguyên tử và khối lượng mol nguyên tử iron (kí hiệu là Fe) lần lượt là 1,28 Å và 56 g/mol. Tính khối lượng riêng của Fe. Biết rằng trong tinh thể, các tinh thể iron chiếm 74% thể tích, còn lại là phần rỗng.
Hướng dẫn giải:
Đổi 1,28 Å = 1,28.10-8 cm.
Khối lượng của 1 nguyên tử Fe:
Thể tích của 1 nguyên tử Fe:
Khối lượng riêng của iron:
Do Fe chiếm 74% thể tích trong tinh thể nên khối lượng riêng thực tế của Fe là: