Lý thuyết Tính biến thiên enthalpy của phản ứng theo năng lượng liên kết
- Khi các chất trong phản ứng ở thể khí, biến thiên enthalpy phản ứng cũng tính được nếu biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
- Giả sử có phản ứng tổng quát:
aA(g) + bB(g) → mM(g) + nN(g)
Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức:
Trong đó, Eb(A), Eb(B), Eb(M), Eb(N) lần lượt là tổng năng lượng liên kết của tất cả các liên kết trong các phân tử A, B, M, N.
- Năng lượng liên kết của một số loại liên kết được cho ở bảng sau:
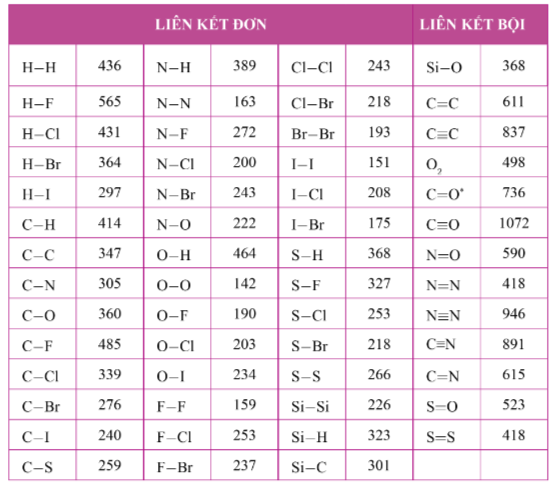
(Trích phụ lục 2 – SGK Hóa học 10 – Cánh diều)
Ví dụ 1: Cho phản ứng hóa học sau:
CH4 (g) + Cl2 (g) → CH3Cl (g) + HCl (g)
Biết năng lượng liên kết (kJmol-1) trong các chất cho ở bảng sau:
|
C – H |
Cl – Cl |
C – Cl |
H – Cl |
|
414 |
243 |
339 |
431 |
Biến thiên enthalpy chuẩn của phản ứng trên được tính theo năng lượng liên kết là
A. -113 kJ.
B. +113 kJ.
C. -527 kJ.
D. +527 kJ.
Hướng dẫn giải
Đáp án đúng là: A
Biến thiên enthalpy chuẩn của phản ứng trên được tính theo năng lượng liên kết là
= 1 × 4EC – H + 1 × ECl – Cl – 1 × (3EC – H + EC – Cl) – 1 × EH – Cl
= 1 × 4 × 414 + 1 × 243 - 1×(3×414 + 339) - 1×431 = -113 (kJ).
Ví dụ 2: Cho phản ứng hóa học sau:
3H2 (g) + N2 (g) → 2NH3 (g)
Biết năng lượng liên kết (kJmol-1) trong các chất như sau:
|
H – H |
N ≡ N |
N – H |
|
432 |
945 |
391 |
Biến thiên enthalpy chuẩn của phản ứng trên được tính theo năng lượng liên kết là
A. +105 kJ.
B. -105 kJ.
C. +986 kJ.
D. -986 kJ.
Hướng dẫn giải
Đáp án đúng là: B
Biến thiên enthalpy chuẩn của phản ứng trên được tính theo năng lượng liên kết là
= 3 × Eb (H – H) + Eb (N ≡ N) – 2 × 3 × Eb (N – H)
= 3 × 432 + 945 - 2 × 3 × 391 = -105 kJ.