Lý thuyết Tính biến thiên enthalpy phản ứng theo enthalpy tạo thành
Giả sử có phản ứng tổng quát:
aA + bB → mM + nN
Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức:
Giá trị enthalpy tạo thành chuẩn của một số chất được cho ở bảng sau:
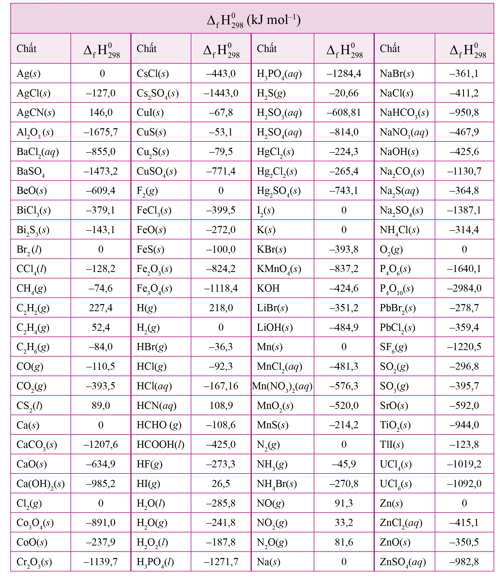
(Trích phụ lục 3 – SGK Hóa học 10 – Cánh diều)
Chú ý:
- Với các phản ứng có kèm theo sự trao đổi năng lượng dưới dạng nhiệt, có hai khả năng sau đây:
+ Phản ứng tỏa nhiệt: biến thiên enthalpy của phản ứng có giá trị âm. Biến thiên enthalpy càng âm, phản ứng tỏa ra càng nhiều nhiệt.
+ Phản ứng thu nhiệt: biến thiên enthalpy của phản ứng có giá trị dương. Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt.
- Các phản ứng tỏa nhiệt (ΔrH0298<0) thường diễn ra thuận lợi hơn các phản ứng thu nhiệt (ΔrH0298>0).
II. Ví dụ minh họa
Ví dụ 1: Cho phản ứng: 2NaCl (s) → 2Na (s) + Cl2 (g)
Biết ΔfH0298(NaCl)=-411,2(kJmol-1). Biến thiên enthalpy chuẩn của phản ứng này là
A. -822,4 kJ.
B. +822,4 kJ.
C. -411,2 kJ.
D. +411,2 kJ.
Hướng dẫn giải:
Đáp án đúng là: B
Biến thiên enthalpy chuẩn của phản ứng:
ΔrH0298=2×ΔfH0298(Na(s))+1×ΔfH0298(Cl2(g))-2×ΔfH0298(NaCl(s))
= 2 × 0 + 1 × 0 – 2 × (-411,2) = 822,4 (kJ).
Ví dụ 2:
Cho phản ứng:
Tính nhiệt tạo thành chuẩn của khí SO2 biết ΔfH0298(SO3(l))=-441,0kJmol-1.
Hướng dẫn giải:
Ta có:
ΔrH0298=2×ΔfH0298(SO3(l))-2×ΔfH0298(SO2(g))-ΔfH0298(O2(g))⇔-288,4=2×(-441,0)-2×ΔfH0298(SO2(g))-0⇔ΔfH0298(SO2(g))=-296,8kJmol-1