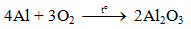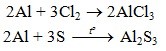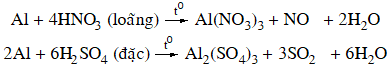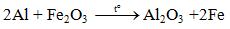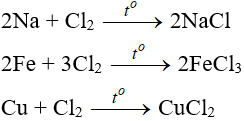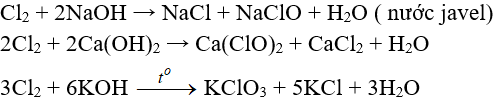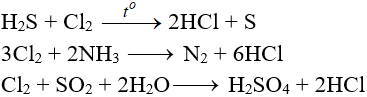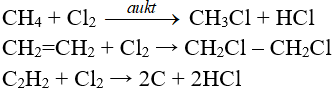Al + Cl2 → AlCl3 | Al ra AlCl3
Sinx.edu.vn xin giới thiệu phương trình Al + Cl2 → AlCl3 là phản ứng hóa hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Al + Cl2 → AlCl3
1. Phương trình phản ứng
2Al + 3Cl2 → 2AlCl3
2. Điều kiện phản ứng
Nhiệt độ thường
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của Al (Nhôm)
Al tác dụng được với một số phi kim.
3.2. Bản chất của Cl2 (Clo)
Cl2 có khả năng cho phản ứng với hầu hết các kim loại (trừ Au và Pt) ở điều kiện nhiệt độ để tạo thành các muối halogenua.
4. Tính chất hoá học của Al
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
4.1. Tác dụng với phi kim
a) Tác dụng với oxi
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
4.2. Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
4.3. Tác dụng với oxit kim loại (Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
4.4. Tác dụng với nước
Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
4.5. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
4.6. Tác dụng với dung dịch muối
Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
4.7. Ứng dụng của Al
Máy cắt rất dễ kiếm và các bộ phận trong nhà máy sản xuất được làm bằng Al. Với đặc tính sáng và không rỉ sét, Al dần trở thành vật liệu không thể thiếu đối với mọi nhà máy. Một số mặt hàng được làm bằng Al, chẳng hạn như: Khung xe máy, khung xe hơi, thùng xe tải, các chi tiết tản nhiệt...
Đặc biệt, Al được sử dụng trong sản xuất trong ngành hàng không vũ trụ. Thân máy bay và cánh được làm bằng nhôm. Các ứng dụng dựa vào trọng lượng riêng nhẹ và bền của nhôm là rất cần thiết để tiết kiệm tối đa trọng lượng trong không khí.
5. Tính chất hóa học của Cl2
5.1. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất)
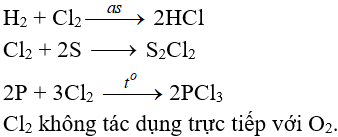
5.2. Tác dụng với phi kim
(cần có nhiệt độ hoặc có ánh sáng)
5.3. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất oxi hóa, vừa là chất khử.
Tác dụng với nuớc:
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
Tác dụng với dung dịch bazơ:
5.4. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
5.5. Tác dụng với chất khử khác
5.6. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
6. Bài tập vận dụng liên quan
Câu 1. Để phân biệt 3 gói bột: Fe, Cu và Al có thể dùng các dung dịch
A. KOH và FeCl2
B. HCl và CuCl2
C. Ba(OH)2 và KCl
D. HCl và KOH
Lời giải:
Đáp án: D
Câu 2. Cho 1,02 gam oxit của một kim loại có công thức là A2O3 tác dụng vừa đủ 300 ml dung dịch HCl 0,2M. Công thức oxit đó.
A. Fe2O3
B. Al2O3
C. Cr2O3
D. Mn2O3
Lời giải:
Đáp án: B
nHCl = 0,2.0,3 = 0,06
A2O3 + 6HCl → 2ACl3 + 3H2O
x mol 6 mol
Ta có: 6x = 0,06 => x = 0,01 mol
=> MA2O3 = 1,02/0,01= 102 (g/mol) => MA = (102−3.12)/2= 27 (g/mol)
Câu 3. Dãy gồm các chất tác dụng được với kim loại nhôm là
A. dung dịch HCl, Cu(OH)2, Cl2 và dung dịch MgCl2
B. dung dịch HCl, dung dịch NaOH, Cl2 và dung dịch ZnCl2
C. SO2, dung dịch Ca(OH)2, S và dung dịch H2SO4 đặc, nguội
D. S, dung dịch MgCl2, SO2 và dung dịch H2SO4 loãng
Lời giải:
Đáp án: B
Câu 4. Để thu được muối AlCl3 tinh khiết từ hỗn hợp AlCl3 và CuCl2, có thể dùng kim loại
A. Fe
B. Cu
C. Al
D. Zn
Lời giải:
Đáp án: C