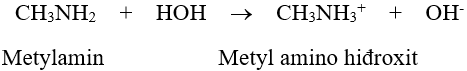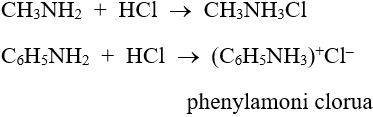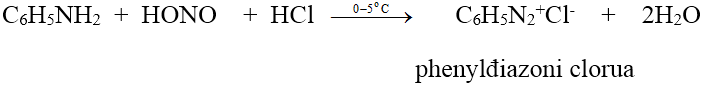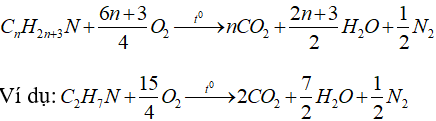CH3NH2 + H2SO4 → (CH3NH3)2SO4 | CH3NH2 ra (CH3NH3)2SO4
Sinx.edu.vn xin giới thiệu phương trình CH3NH2 + H2SO4 → (CH3NH3)2SO4 là phản ứng hóa hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng CH3NH2 + H2SO4 → (CH3NH3)2SO4
1. Phương trình Metylamin phản ứng với dung dịch H2SO4
2CH3NH2 + H2SO4 → (CH3NH3)2SO4
2. Điều kiện để Metylamin phản ứng với dung dịch H2SO4
Nhiệt độ thường
Nếu Metylamin phản ứng với dung dịch H2SO4 với tỷ lệ (1:1)
CH3NH2 + H2SO4 → CH3NH3HSO4
3. Cách thực hiện phản ứng
Cho CH3NH2 phản ứng với H2SO4
4. Hiện tượng nhận biết phản ứng
Không có hiện tượng nhận biết đặc biệt.
5. Bản chất của CH3NH2 (Metylamin) trong phản ứng
Do nguyên tử N trong amin ở trạng thái lai hóa sp3 trên N vẫn còn cặp e tự do chưa liên kết, có thể nhận proton theo thuyết Bronstet nên amin có tính bazơ tác dụng được với axit.
6. Tính chất hóa học của Amin
6.1. Tính bazơ
Do nguyên tử N trong phân tử amin còn cặp e chưa sử dụng có khả năng nhận proton.
* So sánh tính bazơ của các amin:
+ Nếu nguyên tử N trong phân tử amin được gắn với gốc đẩy e (gốc no: ankyl) thì tính bazơ của amin mạnh hơn so với tính bazơ của NH3. Những amin này làm cho quỳ tím chuyển thành màu xanh.
+ Nếu nguyên tử N trong phân tử amin gắn với các gốc hút e (gốc không no, gốc thơm) thì tính bazơ của amin yếu hơn so với tính bazơ của NH3. Những amin này không làm xanh quỳ tím.
+ Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.
⇒ Lực bazơ: CnH2n + 1–NH2 > H–NH2 > C6H5–NH2
- Dung dịch metylamin và nhiều đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein.
– Amin bậc III mà gốc hiđrocacbon R, R’ và R’’ có số C ≥ 2 thì các gốc R, R’ và R’’ cản trở amin nhận proton H+ ⇒ tính bazơ yếu ⇒ dung dịch không làm đổi màu quỳ tím và phenolphtalein.
- Anilin và các amin thơm rất ít tan trong nước. Dung dịch của chúng không làm đổ màu quỳ tím và phenolphtalein.
- Tác dụng với axit: R–NH2 + HCl → R–NH3Cl
Ví dụ:
- Tác dụng dung dịch muối của các kim loại có hiđroxit kết tủa:
Ví dụ: 3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3↓ + 3CH3NH3Cl
- Lưu ý: Khi cho muối của Cu2+, Zn2+, … vào dung dịch amin (dư) → hiđroxit kết tủa → kết tủa tan (tạo phức chất).
6.2. Phản ứng với axit nitrơ HNO2
- Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ.
C2H5NH2 + HONO → C2H5OH + N2↑ + H2O
- Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 - 5oC) cho muối điazoni:
6.3. Phản ứng ankyl hóa
Amin bậc một hoặc bậc hai tác dụng với ankyl halogenua (CH3I, …) , nguyên tử H của nhóm amin có thể bị thay thế bởi gốc ankyl:
Ví dụ: C2H5NH2 + CH3I → C2H5NHCH3 + HI
– Phản ứng này dùng để điều chế amin bậc cao từ amin bậc thấp hơn.
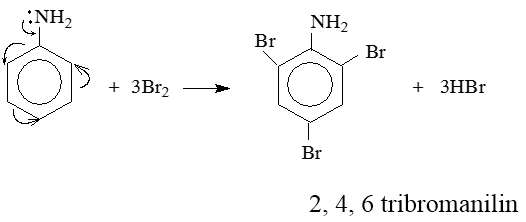
6.4. Phản ứng thế ở nhân thơm của anilin
Do ảnh hưởng của nhóm NH2 (tương tự nhóm –OH ở phenol), ba nguyên tử H ở các vị trí ortho và para so với nhóm –NH2 trong nhân thơm của anilin bị thay thế bởi ba nguyên tử brom:
Lưu ý: Phản ứng tạo ra kết tủa trắng 2, 4, 6 tribromanilin dùng nhận biết anilin.
6.5. Phản ứng cháy của amin no đơn chức mạch hở
7. Tính chất vật lí và nhận biết Amin
- Metyl–, đimetyl–, trimetyl– và etylamin là những chất khí có mùi khai khó chịu, độc, dễ tan trong nước, các amin đồng đẳng cao hơn là chất lỏng hoặc rắn.
- Anilin là chất lỏng, nhiệt độ sôi là 184°C, không màu, rất độc, ít tan trong nước, tan trong ancol và benzen.
8. Tính chất hóa học của H2SO4
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
9. Bài tập vận dụng
Câu 1. Dãy gồm các chất đều làm giấy quỳ tím ẩm chuyển sang màu xanh là:
A. Amoni clorua, metyl amin, natri hidroxit.
B. Metyl amin, amoniac, natri axetat.
C. Anilin, metyl amin, amoniac.
D. Anilin, amoniac, natri hidroxit.
Lời giải:
Đáp án: B
Câu 2. Dãy chất nào sau đây phản ứng được với metylamin
A. CH2=CH–COOH, NH3 và FeCl2
B. NaOH, HCl và AlCl3
C. CH3COOH, FeCl2 và HNO3
D. Cu, NH3 và H2SO4
Lời giải:
Đáp án: C
Giải thích:
CH3COOH, FeCl2và HNO3
Câu 3. Metylaminphản ứng với dung dịch H2SO4 thu được sản phẩm là
A. C2H5NH3HSO4.
B. CH3NH3HSO4.
C. (C2H5NH3)2SO4.
D. CH3NH3Cl.
Lời giải:
Đáp án: B
Câu 4. Anilin có công thức phân tử là?
A. C6H5NH2
B. C3H5NH2
C. C6H5OH
D. CH3NH2
Lời giải:
Đáp án: A
Câu 5. Để rửa sạch lọ đã đựng anilin người ta dùng
A. dung dịch NaOH và nước.
B. dung dịch HCl và nước.
C. dung dịch amoniac và nước.
D. dung dịch NaCl và nước.
Lời giải:
Đáp án: B