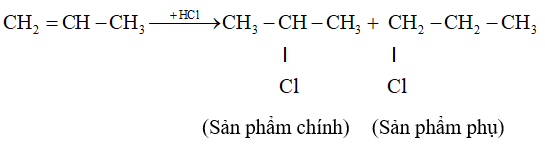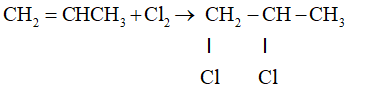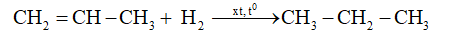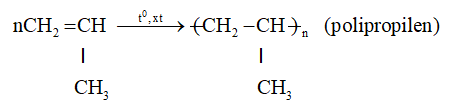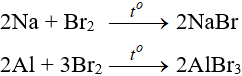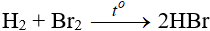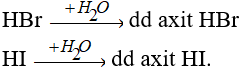C3H6 ra C3H6Br2 l C3H6+Br2 → C3H6Br2
Sinx.edu.vn xin giới thiệu phương trình: C3H6+Br2 → C3H6Br2 là phản ứng cộng. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng C3H6+Br2 → C3H6Br2
1. Phương trình phản ứng Propen tác dụng với Br2
C3H6+Br2→ C3H6Br2
CH2=CH–CH3 + Br2 → CH2Br–CHBr–CH3
2. Điều kiện phản ứng xảy ra
Nhiệt độ thường
3. Bản chất của các chất tham gia phản ứng
Bản chất của C3H6 (Propen) trong phản ứng : Do liên kết kém bền trong liên kết đôi bị đứt ra.
4. Propen tác dụng với Br2 có hiện tượng gì
Dẫn khí propilen từ từ qua dung dịch brom thấy màu nâu đỏ của dung dịch nhạt dần.
5. Cách thực hiện phản ứng
Dẫn khí propilen từ từ qua dung dịch brom
6. Tính chất của C3H6
6.1 Tính chất hóa học của C3H6
a. Phản ứng cộng
- Hướng phản ứng cộng axit và nước vào anken.
Phản ứng cộng axit hoặc nước vào propen thường tạo ra hỗn hợp 2 đồng phân, trong đó 1 đồng phân là sản phẩm chính.
- Cộng Brom
- Phản ứng cộng hiđro (phản ứng hiđro hóa)
b. Phản ứng trùng hợp
- Propen trong điều kiện nhiệt độ, áp xuất, xúc tác thích hợp thì tham gia phản ứng cộng nhiều phân tử với nhau thành những phân tử mạch rất dài và có khối lượng phân tử rất lớn. Người ta gọi đó là phản ứng trùng hợp.
c. Phản ứng oxi hóa
- Propen cháy hoàn toàn tạo ra CO2, H2O và tỏa nhiều nhiệt:
C3H6 + O2 → 3CO2 + 3H2O
- Propen làm mất màu dung dịch KMnO4:
3C3H6 + 2KMnO4 + 4H2O → 2KOH + 2MnO2 + 3C3H6(OH)2
- Phản ứng làm mất màu dung dịch thuốc tím kali pemanganat được dùng để nhận ra sự có mặt của liên kết đôi của anken.
6.2. Tính chất vật lí của C3H6
- Propen là chất khí, không màu, có mùi giống như dầu mỏ. Trong quá trình tự nhiên, propen là một sản phẩm phụ của quá trình lên men tự nhiên, quá trình lọc dầu và chế biến khí tự nhiên.
- Nhận biết: Dẫn khí propen qua dung dịch brom màu da cam. Hiện tượng: Dung dịch brom bị mất màu.
7. Tính chất hóa học của Br2
7.1. Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
7.2. Tác dụng với hidro
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
7.3. Tính khử của Br2, HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
8. Bạn có biết
- Phản ứng trên gọi là phản ứng cộng.
- Các đồng đẳng của propilen đều làm mất màu dung dịch brom.
- Phản ứng trên dung để phân biệt anken với ankan.
9. Câu hỏi vận dụng
Câu 1. Hợp chất hữu cơ không làm mất màu brom trong CCl4 là
A. isobutilen.
B. ancol anlylic.
C. anđehit acrylic.
D. anđehit ađipic
Lời giải:
Đáp án: D
Câu 2. Chất nào sau đây làm mất màu nước brom?
A. propan
B. metan
C. propen
D. cacbonđioxit
Lời giải:
Đáp án: C
Giải thích:
Phương trình phản ứng hóa học
CH2=CH–CH3 + Br2 → CH2Br–CHBr–CH3
Câu 3. Cho các chất sau: propan, etilen, propin, buta-1,3-đien, stiren, glixerol, phenol, vinyl axetat, anilin. Số chất tác dụng được với nước Br2 ở điều kiện thường là
A. 8
B. 7
C. 9
D. 6
Lời giải:
Đáp án: B
Giải thích:
Chất tác dụng được với nước Br2 ở điều kiện thường là: etilen, propin, buta-1,3-đien, stiren, phenol, vinyl axetat, anilin
C2H4 + Br2→ C2H4Br2
C3H4+ Br2→ C3H4Br2
CH2=CH−CH=CH2 + Br2→ CH2Br−CHBr−CH=CH2
C6H5-CH=CH2+ Br2 → C6H5-CHBr-CH2Br
Br2 + CH3COOCH=CH2 → CH3COOCH(Br)-CH2Br
C6H5NH2 + 3Br2 → C6H3Br3NH2 + 3HBr
Câu 4. Chất nào sau đây khi tác dụng với HBr chỉ cho một sản phẩm duy nhất?
A. But-1-en.
B. 2,3-đimetylbut-2-en.
C. propen.
D. 2-metylbut-2-en
Lời giải:
Đáp án: B
Câu 5. Chất nào sau đây không làm mất màu dung dịch Br2?
A. Metan.
B. Etilen.
C. Propilen.
D. Axetilen.
Lời giải:
Đáp án: A
Câu 6. Thực hiện các thí nghiệm sau:
(a) Cho anilin vào dung dịch nước brom
(b) Đun nóng tinh bột trong dung dịch H2SO4 loãng.
(c) Sục khí H2 vào nồi kín chứa triolein (xúc tác Ni), đun nóng.
(d) Nhỏ vài giọt nước brom vào dung dịch stiren.
(e) Cho dung dịch AgNO3/NH3 vào glucozo đun nóng
(g) Cho dung dịch metyl fomat vào dung dịch AgNO3 trong NH3, đun nóng.
Số thí nghiệm xảy ra phản ứng là
A. 3
B. 5
C. 6
D. 4
Lời giải:
Đáp án: C
Giải thích:
Các thí nghiệm xảy ra phản ứng là
(a) C6H5NH2 + 3Br2 → C6H3Br3NH2 + 3HBr
(b) (C6H10O5) nC6H12O6 (glucozo)
(c) 3H2 + (C17H33COO)3C3H5 (C17H35COO)3C3H5
(d) C6H5-CH=CH2+ Br2 → C6H5-CHBr-CH2Br
(e) C6H12O6+ 8AgNO3+ 4NH3 → 8Ag + 6CO2+ 6NH4NO3
(g) HCOOCH3 + 2AgNO3 + 2NH3 + H2O NH4OOCCH3 + 2Ag↓ + NH4NO3
=> cả 6 thí nghiệm đều xảy ra phản ứng
Câu 7. Hỗn hợp X gồm C3H8 và C3H6 có tỉ khối so với hiđro là 21,8. Đốt cháy hết 5,6 lít X (đktc) thì thu được bao nhiêu gam CO2 và bao nhiêu gam H2O?
A. 33 gam và 17,1 gam.
B. 22 gam và 9,9 gam.
C. 13,2 gam và 7,2 gam.
D. 33 gam và 21,6 gam.
Lời giải:
Đáp án: A
Giải thích:
C3H6 + 9/2O2 → 3CO2 + 3H2O
C3H8 + 5O2 → 3CO2 + 4H2O
nX= 0,25 mol ⇒ nCO2 = 0,25.3 = 0,75 mol
mCO2 = 0,75.44 = 33 gam;
mX = mC + mH ⇔ 21,8.2.0,25 = 0,75.12 + 2.nH2O
⇒ nH2O= 0,95 mol; mH2O = 18.0,95 = 17,1 gam