NaAlO2 + CO2 + H2O → Al(OH)3 + Na2CO3 | NaAlO2 ra Na2CO3 | NaAlO2 ra Al(OH)3
Sinx.edu.vn xin giới thiệu phương trình NaAlO2 + CO2 + H2O → Al(OH)3 + Na2CO3 là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng NaAlO2 + CO2 + H2O → Al(OH)3 + Na2CO3
1. Phương trình phản ứng khi Sục CO2 vào NaAlO2
CO2 + 2NaAlO2 + 3H2O → 2Al(OH)3 + Na2CO3
2. Điều kiện để phản ứng khí CO2 sục vào NaAlO2
Nhiệt độ thường
3. Hiện tượng sục khí CO2 dư vào dung dịch NaAlO2
Khi sục khí CO2 đến dư vào dung dịch NaAlO2 sau phản ứng thấy xuất hiện kết tủa keo trắng, phản ứng CO2 không phản ứng tiếp với Al(OH)3 vì oxit axit không phản ứng với bazơ không tan.
4. Tính chất hoá học của NaAlO2
4.1. Tính chất vật lí & nhận biết
- Tính chất vật lí: Là chất rắn, màu trắng, không mùi, tan tốt trong nước cho dung dịch không màu.
- Nhận biết: Sục CO2 vào dung dịch, thấy xuất hiện kết tủa keo trắng
2H2O + NaAlO2 + CO2 → Al(OH)3↓ + NaHCO3
4.2. Tính chất hóa học
- Tác dụng với axit:
2H2O + NaAlO2 + CO2 → Al(OH)3↓ + NaHCO3
H2O + HCl + NaAlO2 → Al(OH)3↓ + NaCl
4.3. Điều chế
- Điều chế bằng cách cho nhôm phản ứng với dung dịch NaOH.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
4.4. Ứng dụng
Trong việc xử lý nước nó được dùng như là chất thêm vào trong hệ thống làm mềm nước, như là chất đông tụ để cải thiện sự kết tụ, và để loại bỏ silica và các hợp chất phosphat hoà tan.
Trong công nghệ xây dựng, natri aluminat được dùng để tăng nhanh tốc độ hoá rắn của bê tông, chủ yếu khi làm việc trong điều kiện lạnh giá.
Natri aluminat còn được dùng trong công nghiệp giấy, sản xuất gạch chịu lửa, sản xuất alumina, v. v…
Dung dịch natri aluminat là trung gian trong sản xuất các zeolit
5. Tính chất hóa học của CO2
Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
5.1. CO2 là oxit axit
- CO2 tan trong nước tạo thành axit cacbonic (là một điaxit rất yếu):
CO2 (k) + H2O (l) ⇔ H2CO3 (dd)
- CO2 tác dụng với oxit bazơ → muối:
CaO + CO2 → CaCO3 (tº)
- CO2 tác dụng với dung dịch kiềm → muối + (H2O)
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Phản ứng của CO2 với dung dịch kiềm tạo thành muối nào tuỳ thuộc vào tỉ lệ số mol của 2 chất tham gia phản ứng.
5.2. CO2 bền
Ở nhiệt độ cao bị nhiệt phân một phần và tác dụng được với các chất khử mạnh
2CO2 ⇔ 2CO + O2 (tº)
CO2 + 2Mg → 2MgO + C (Đây là nguyên nhân không sử dụng CO2 để dập tắt các đám cháy kim loại)
CO2 + C → 2CO
5.3. Sản xuất ure
CO2 + 2NH3 → NH4O - CO - NH2 (amoni cacbamat)
NH4O - CO - NH2 → H2O + (NH2)2CO (180ºC; 200at)
6. Bài tập vận dụng
Câu 1. Nhận định nào sau đây không đúng khi nhắc về kim loại kiềm?
A. Đều có cấu tạo mạng tinh thể giống nhau: lập phương tâm khối
B. Kim loại kiềm là những nguyên tố mà nguyên tử có 1 e ở phân lớp p
C. Kim loại kiềm fễ bị oxi hóa
D. Năng lượng ion hóa thứ nhất của các nguyên tử kim loại kiềm thấp hơn so với các nguyên tố khác trong cùng chu kì
Lời giải:
Đáp án: B
Câu 2. Sục khí CO2 vào dung dịch NaAlO2
A. Không có hiện tượng gì
B. Dung dịch vẩn đục
C. Dung dịch trong suốt sau bị vẩn đục
D. Dung dịch có màu trong suốt
Lời giải:
Đáp án: B
Giải thích:
Có kết tủa keo trắng không tan.
NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3.
Câu 3. Dãy nào dưới đây gồm các chất vừa tác dụng với dung dịch axit HCl vừa tác dụng với dung dịch kiềm NaOH?
A. AlCl3 và Al2(SO4)3.
B. Al(NO3)3 và Al(OH)3.
C. Al2(SO4)3 và Al2O3.
D. Al(OH)3 và Al2O3.
Lời giải:
Đáp án: D
Câu 4. Khi cho từ từ khí CO2 đến dư vào dung dịch NaAlO2. Hiên tượng quan sát được là
A. xuất hiện kết tủa keo trắng
B. lúc đầu xuất hiện kết tủa keo trắng sau đó kết tủa tan hết.
C. không có hiện tượng gì xảy ra
D. xuất hiện kết tủa keo trắng, sau đó kết tủa bị hoà tan một phần.
Lời giải:
Đáp án: A
Giải thích:
Khi cho từ từ khí CO2 đến dư vào dung dịch NaAlO2. Hiên tượng quan sát được là xuất hiện kết tủa keo trắng
Câu 5. Cho các thí nghiệm sau
(1) Cho Ba vào dung dịch chứa phèn chua
(2) Cho FeCl2 vào dung dịch AgNO3
(3) Cho Ca(OH)2 vào Mg(HCO3)2
(4) Sục khí NH3 vào dung dịch hỗn hợp CuCl2 và AlCl3
(5) Cho một miếng nhôm vào dung dịch NaOH dư rồi sục khí CO2 vào
Tổng số thí nghiệm có khả năng tạo kết tủa là:
A. 2
B. 5
C. 3
D. 4
Lời giải:
Đáp án: B
Giải thích:
(1) tạo kết tủa BaSO4 có thể có thêm Al(OH)3
Ba + 2H2O → Ba(OH)2 + H2↑
Ba2+ + SO42- → BaSO4↓ + H2O
Al3+ + 3OH- → Al(OH)3↓
(2) tạo kết tủa AgCl và Ag
FeCl2 + 2AgNO3 → 2AgCl↓ + Fe(NO3)2
Fe(NO3)2 + AgNO3 → Ag↓ + Fe(NO3)3
(3) tạo kết tủa CaCO3 và MgCO3
Ca(OH)2 + Mg(HCO3)2 → CaCO3↓ + MgCO3↓ + 2H2O
(4) tạo Al(OH)3 có thể có Cu(OH)2
NH3 + H2O + AlCl3 → Al(OH)3↓ + NH4Cl
NH3 + H2O + CuCl2 → Cu(OH)2↓ + NH4Cl
4NH3 + Cu(OH)2 → Cu(NH3)4(OH)2 phức tan
(5) tạo kết tủa Al(OH)3 không tan trong CO2
Al + NaOH + H2O → NaAlO2 + 3/2H2↑
Câu 6. Sục khí CO2 đến dư vào dung dịch NaAlO2 hiện tượng xảy ra là
A. Không có hiện tượng gì.
B. có kết tủa keo trắng, sau đó kết tủa lại tan.
C. có kết tủa keo trắng.
D. dung dịch vẫn trong suốt.
Lời giải:
Đáp án: C
Câu 7. Sục từ từ khí CO2 đến dư vào dung dịch hỗn hợp chứa Ca(OH)2 và NaAlO2. Khối lượng kết tủa thu được sau phản ứng được biểu diễn trên đồ thị sau:
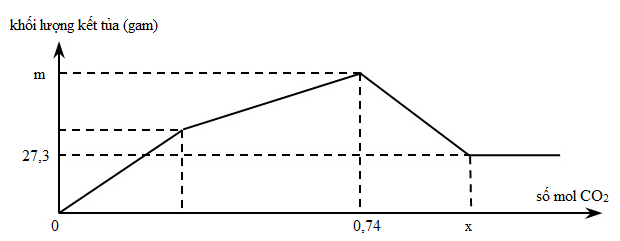
Giá trị của m và x là
A. 66,3 và 1,31.
B. 66,3 và 1,13.
C. 39,0 và 1,31.
D. 39,0 và 1,13.
Lời giải:
Đáp án: B
Giải thích:
mAl(OH)3 = 27,3 gam => nAl(OH)3 = nAlO2- = 0,35 mol
Thứ tự phản ứng:
(1) CO2 + 2H2O + AlO2- → Al(OH)3 + HCO3-
(2) CO2 + Ca(OH)2 → CaCO3 + H2O
(3) CO2 + CaCO3 + H2O → Ca(HCO3)2
Tại nCO2 = 0,74 mol thì cả Al(OH)3 và CaCO3 đạt giá trị lớn nhất, phản ứng (2) vừa kết thúc:
nCO2= nAlO2- + nCa(OH)2 => 0,74 = 0,35 + nCa(OH)2 => nCa(OH)2 = 0,39 mol
=> m = mCaCO3+ mAl(OH)3 = 0,39.100 + 0,35.78 = 66,3 gam
- Tại nCO2 = x: CaCO3 bị hòa tan hết, phản ứng (3) vừa kết thúc
x = nCO2 = nAlO2- + 2nCa(OH)2 = 0,35 + 2.0,39 = 1,13 mol
Câu 8. Cho các chất: Al(OH)3; NaAlO2; Al2O3; Zn(OH)2; Mg(OH)2; ZnO; SO2; NaHCO3; K2HPO4; KHS; KHSO3; Na2ZnO2; AgNO3 và Fe(OH)3. Có mấy chất trong dãy có tính chất lưỡng tính:
A. 7
B. 8
C. 9
D. 10
Lời giải:
Đáp án: B
Giải thích:
Các chất có tính lưỡng tính là: Al(OH)3; Al2O3; Zn(OH)2; ZnO; NaHCO3; K2HPO4; KHS; KHSO3.