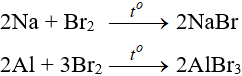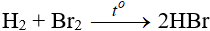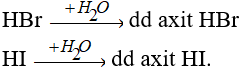SO2 + Br2 + H2O → HBr + H2SO4 | SO2 ra H2SO4 | Br2 ra H2SO4 | SO2 ra HBr
Sinx.edu.vn xin giới thiệu phương trình SO2 + Br2 + H2O → HBr + H2SO4 là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng SO2 + Br2 + H2O → HBr + H2SO4
1. Phương trình phản ứng SO2 ra HBr
SO2 + Br2 + 2H2O → 2HBr + H2SO4
2. Điều kiện phản ứng xảy ra SO2 và dung dịch Br2
Nhiệt độ thường
3. Cân bằng phản ứng SO2 + Br2+ H2O → H2SO4 + HBr bằng phương pháp thăng bằng electron
Bước 1. Xác định sự thay đổi số oxi hóa
S+4O2 + Br02 + H2O → 2HBr-1 + H2S+6O4
Bước 2: Lập thăng bằng electron
Quá trình nhường e
S+4 → S+ 6 + 2e
Quá trình nhận e
Br0 + 1e →Br-1
Đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại
SO2 + Br2+ 2H2O → 2HBr + H2SO4
4. Hiện tượng phản ứng xảy ra SO2 và Br2
Khi dẫn khí SO2 vào dung dịch Brom có màu vàng nâu nhạt, dung dịch Brom bị mất màu.
SO2 đã khử Br2 có màu thành HBr không màu.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của SO2 (Lưu huỳnh dioxit)
- Trong phản ứng trên SO2 là chất khử.
- SO2 làm mất màu nước Br2.
5.2. Bản chất của Br2 (Brom)
Trong phản ứng trên Br2 là chất oxi hoá.
6. Tính chất hoá học của SO2
* Lưu huỳnh đioxit tác dụng với nước:
SO2 + H2O ⇋ H2SO3
* Lưu huỳnh đioxit tác dụng với dung dịch bazơ (có thể tạo thành 2 loại muối sunfit và hiđrosunfit)
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
* Lưu huỳnh đioxit tác dụng với oxit bazơ → muối:
SO2 + CaO → CaSO3
SO2 vừa là chất khử, vừa là chất oxi hóa (do S trong SO2 có mức oxi hóa trung gian +4)
* Lưu huỳnh đioxit là chất oxi hóa:
SO2 + 2H2S → 3S + 2H2O
Lưu huỳnh đioxit là chất khử
7. Ứng dụng của SO2
- Trong phòng thí nghiệm, SO2 được điều chế bằng cách cho muối sunfit tác dụng với axit mạnh như HCl, H2SO4.
Ví dụ: Na2SO3 + 2 HCl → 2 NaCl + H2O + SO2
- Ngoài ra, khí SO2 còn được điều chế bằng cách cho Cu tác dụng với H2SO4 đặc.
Cu + 2H2SO2 đặc → CuSO4 + SO2 + 2H2O
Khí SO2 được thu bằng phương pháp đẩy không khí.
8. Tính chất hóa học của Br2
8.1. Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
8.2. Tác dụng với hidro
- Độ hoạt động giảm dần từ Cl → Br → I
- Các khí HBr, HI tan vào nước tạo dung dịch axit.
- Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
8.3. Tính khử của Br2, HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
9. Bài tập vận dụng
Câu 1. Cho vào ống nghiệm một ít tinh thể KMnO4 và vài giọt dung dịch HCl đặc. Đậy ống
nghiệm bằng nút cao su có dính một băng giấy màu ẩm. Màu của băng giấy thay đổi thế nào
A. Băng giấy mất màu
B. Không hiện tượng gì
C. Băng giấy chuyển màu đỏ
D. Băng giấy chuyển màu xanh
Lời giải:
Đáp án: A
Câu 2. Nhận biết khí SO2 ta dùng dung dịch nước Br2 dư hiện tượng xảy ra là:
A. dung dịch Br2, mất màu
B. dung dịch Br2 chuyển sang màu da cam
C. Dung dịch Br2 chuyển thành màu xanh
D. Không hiện tượng
Lời giải:
Đáp án: A
Giải thích:
Phương trình phản ứng hóa học
SO2 + Br2 + H2O → 2HBr + H2SO4
Câu 3. Có các nhận định sau về nhóm oxi:
(a) Ở điều kiện thường H2S, H2Se, H2Te là những chất khí, có mùi khó chịu và độc.
(b) Dung dịch của H2S, H2Se, H2Te trong nước có tính axit yếu.
(c) H2SO4, H2SeO4, H2TeO4 là những axit.
(d) Theo chiều từ H2O, H2S, H2Se, H2Te tính bền của phân tử giảm dần.
Số nhận định đúng là
A. 4
B. 3
C. 2
D. 1
Lời giải:
Đáp án: A
Câu 4. Trường hợp nào sau đây không xảy ra phản ứng hóa học?
A. 3O2 + 2H2S → 2H2O + 2SO2
B. FeCl2 + H2S → FeS + 2HCl
C. SO2 + 2H2S → 3S + 2H2O
D. SO3 + 2NaOH → Na2SO4 + H2O
Lời giải:
Đáp án: B
Câu 5. Có các thí nghiệm sau:
(1) Nhúng thanh đồng vào dung dịch HCl.
(2) Sục khí SO2 vào nước brom.
(3) Sục khí CO2 vào nước Gia-ven.
(4) Đổ dung dịch HF vào bình thủy tinh
Số thí nghiệm xảy ra phản ứng hóa học là bao nhiêu?
A. 4.
B. 3.
C. 2.
D. 1.
Lời giải:
Đáp án: B
Câu 6. Cho phản ứng: SO2+ Br2 + 2H2O → H2SO4+ 2HBr. Vai trò của Br2 trong phản ứng trên là gì?
A. chất bị oxi hóa.
B. chất bị khử.
C. không là chất oxi hóa, không là chất khử
D. vừa là chất oxi hóa vừa là chất khử.
Lời giải:
Đáp án: D
Câu 7. Khi sục SO2 vào dung dịch H2S thì
A. Dung dịch bị vẩn đục màu vàng.
B. Tạo thành chất rắn màu đỏ.
C. Không có hiện tượng gì.
D. Dung dịch chuyển thành màu nâu đen.
Lời giải:
Đáp án: A
Khi sục SO2 vào dung dịch H2S thì xảy ra phản ứng: SO2 + 2H2S → 3S↓ + 2H2O
Vậy hiện tượng là dung dịch bị vẩn đục màu vàng (S).
Câu 8. Cho phản ứng: SO2 + Br2 + 2H2O → H2SO4 + 2HBr.
Trong phản ứng trên, brom đóng vai trò
A. chất khử.
B. không là chất oxi hóa, không là chất khử.
C. vừa là chất oxi hóa, vừa là chất khử.
D. chất oxi hóa.
Lời giải:
Đáp án: D
Câu 9. Cho phản ứng hóa học: SO2 + Br2 + H2O → HBr + H2SO4. Hệ số của chất oxi hóa và hệ số của chất khử trong phương trình hóa học của phản ứng trên là:
A. 1 và 1.
B. 2 và 1.
C. 1 và 2.
D. 2 và 2
Lời giải:
Đáp án: A
Giải thích:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
S+4 → S+6 + 2e => SO2 là chất khử (hệ số là 1)
Br0 + 1e → Br- => Br2 là chất oxi hóa (hệ số là 1)
Câu 10. Hiện tượng xảy ra khi dẫn khí SO2 vào dung dịch brom là
A. có kết tủa màu vàng.
B. có khói màu nâu đỏ.
C. có khí mùi hắc thoát ra.
D. dung dịch brom mất màu
Lời giải:
Đáp án: A
Giải thích:
Dung dịch Br2 có màu nâu đỏ, khi sục SO2 vào dung dịch nước Br2 thì dung dịch brom mất màu do xảy ra phản ứng
Phương trình hóa học: SO2 + Br2+ 2H2O → 2HBr + H2SO4
(dung dịch màu nâu đỏ) (dung dịch không màu)
Câu 11. Các đồ vật bằng bạc để lâu trong không khí thường bị xỉn màu đen. Nguyên nhân gây ra hiện tượng này là do:
A. Bạc tác dụng với O2 trong không khí.
B. Bạc tác dụng với hơi nước.
C. Bạc tác dụng đồng thời với khí O2 và H2S trong không khí.
D. Bạc tác dụng với khí CO2.
Lời giải:
Đáp án: C
Giải thích:
Trong không khí có chứa các chất O2, H2S, hơi nước… Vì vậy Ag tác dụng đồng thời với O2 và H2S tạo muối Ag2S màu đen gây ra hiện tượng xỉn màu.
4Ag + O2 + 2H2S → 2Ag2S + 2H2O
Câu 12. Để phân biệt khí CO2 và khí SO2 có thể dùng:
A. Dung dịch nước Br2
B. dung dịch NaOH
C. Dung dịch KNO3
D. dung dịch Ca(OH)2
Lời giải:
Đáp án: A
Giải thích:
Phân biệt CO2 và SO2 bằng dung dịch Br2
Để phân biệt SO2 và CO2 hay cách phân biệt khí CO2 và SO2 thì thuốc thử nên sử dùng là chất có tính Oxi hóa mạnh như thuốc tím [KMnO4] hoặc Br2.
Vì trong 2 khí CO2 và SO2thì chỉ có khí SO2 là có tính khử nên sử dụng chất oxi hóa sẽ nhận biết được khí này.
Do số oxi hóa của lưu huỳnh ( S) đang ở +4 có thể nhường 2 electron để xuất hiện quá trình oxi hóa. Mà khí CO2 với số oxi hóa của cacbon ( C) đang ở mức cao nhất là +4 rồi thế nên không thể làm mất màu thuốc tím được khi bạn thực hiện cho 2 khí này tiếp xúc ở cùng một điều kiện phản ứng như nhau.
Khí SO2 còn làm mất màu của dung dịch nước Brom nữa các bạn nhé.
SO2+ Br2 + 2H2O → H2SO4 + 2HBr