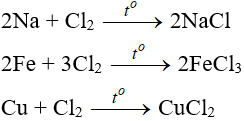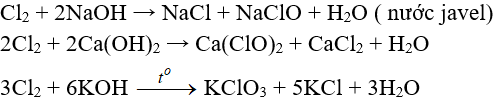SO2 + Cl2 + H2O → HCl + H2SO4 | SO2 ra H2SO4 | SO2 ra HCl
Sinx.edu.vn xin giới thiệu phương trình SO2 + Cl2 + H2O → HCl + H2SO4 là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng SO2 + Cl2 + H2O → HCl + H2SO4
1. Phương trình phản ứng SO2 tác dụng nước Clo
SO2 + Cl2 + 2H2O → 2HCl + H2SO4
2. Điều kiện phản ứng xảy ra phản ứng SO2 và Cl2
Nhiệt độ thường
3. Hiện tượng sau phản ứng SO2 + Cl2
Nước Clo từ từ mất màu vàng nhạt.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của SO2 (Lưu huỳnh dioxit)
- Trong phản ứng trên SO2 là chất khử.
- SO2 là chất khử khi tác dụng một chất oxi hóa mạnh như halogen, kali pemanganat.
4.2. Bản chất của Cl2 (Clo)
Trong phản ứng trên Cl2 là chất oxi hoá.
5. Tính chất hóa học của SO2
Là chất khí không màu, nặng hơn không khí, mùi hắc, độc, tan và tác dụng được với nước.
SO2 là oxit axit
5.1. Lưu huỳnh đioxit tác dụng với nước
SO2 + H2O ⇋ H2SO3
5.2. Lưu huỳnh đioxit tác dụng với dung dịch bazơ
(có thể tạo thành 2 loại muối sunfit và hiđrosunfit)
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
5.3. Lưu huỳnh đioxit Tác dụng với oxit bazơ → muối
SO2 + CaO → CaSO3
SO2 vừa là chất khử, vừa là chất oxi hóa
(do S trong SO2 có mức oxi hóa trung gian +4)
5.4. Lưu huỳnh đioxit là chất oxi hóa
SO2 + 2H2S → 3S + 2H2O
5.5. Lưu huỳnh đioxit là chất khử
2SO2 + O2 ⇋ 2SO3 (V2O5, 4500C)
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4+ 2H2SO4
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
6. Ứng dụng của SO2
- Trong phòng thí nghiệm, SO2 được điều chế bằng cách cho muối sunfit tác dụng với axit mạnh như HCl, H2SO4.
Ví dụ: Na2SO3 + 2 HCl → 2 NaCl + H2O + SO2
- Ngoài ra, khí SO2 còn được điều chế bằng cách cho Cu tác dụng với H2SO4 đặc.
Cu + 2H2SO2 đặc → CuSO4 + SO2 + 2H2O
Khí SO2 được thu bằng phương pháp đẩy không khí.
7. Tính chất hóa học của Cl2
7.1. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất)
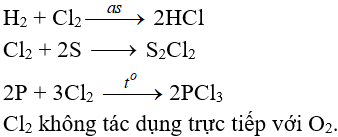
7.2. Tác dụng với phi kim
(cần có nhiệt độ hoặc có ánh sáng)
7.3. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất oxi hóa, vừa là chất khử.
Tác dụng với nuớc:
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
Tác dụng với dung dịch bazơ:
7.4. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
7.5. Tác dụng với chất khử khác
7.6. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
8. Bài tập vận dụng
Câu 1. Nhận định nào sau đây là không chính xác về HCl:
A. Hidroclorua là chất khí không màu, mùi xốc, tan tốt trong nước.
B. Hidroclorua làm quỳ tím ẩm chuyển sang màu đỏ.
C. Axit clohidric hoà tan được nhiều kim loại như sắt, nhôm, đồng.
D. Axit clohidric có cả tính oxi hoá lẫn tính khử.
Lời giải:
Đáp án: C
Giải thích:
C sai vì HCl không hòa tan được Cu (đồng).
Câu 2. Cho phương trình phản ứng sau SO2 + Cl2 + 2H2O → 2HCl + H2SO4
Cl2 đóng vai trò gì trên phản ứng trên.
A. Cl2 là chất oxi hóa, H2O là chất khử.
B. Cl2 là chất oxi hóa, SO2 là chất khử.
C. Cl2 là chất khử, SO2 là chất oxi hóa.
D. SO2 là chất khử, H2O là chất oxi hóa.
Lời giải:
Đáp án: B
Giải thích:
Cl20 + 2e→ 2Cl−1 => Cl2 là chất oxi hóa
S+4 − 2e → S+6 => SO2 là chất khử
Câu 3. Cho phản ứng: SO2 + Cl2 + 2H2O → 2HCl + H2SO4. Vai trò của lưu huỳnh đioxit là
A. oxi hóa
B. vừa oxi hóa, vừa khử
C. khử
D. Không oxi hóa khử
Lời giải:
Đáp án: C
Câu 4. Sục khí SO2 vào cốc đựng nước cất cho quỳ tím vào dung dịch thu được quỳ tím sẽ
A. chuyển màu đỏ.
B. chuyển màu xanh.
C. không chuyển màu.
D. mất màu.
Lời giải:
Đáp án: A
Giải thích:
Khi sục SO2 vào nước thì sẽ tạo dung dịch axit H2SO3, dung dịch axit làm quỳ tím chuyển đỏ.
SO2 + H2O → H2SO3
Câu 5. Phát biểu nào sau đây không đúng khi nói về clo?
A. Tan trong nước tạo thành nước clo có màu vàng nhạt
B. Chỉ thể hiện tính oxi hóa
C. Tác dụng với hiđro tạo thành hỗn hợp nổ
D. Là chất khí màu vàng lục, mùi xốc, độc
Lời giải:
Đáp án: B
Câu 6. Nhỏ từng giọt dung dịch SO2 vào nước Clo. Sau phản ứng thấy hiện tượng gì
A. Không có hiện tượng gì
B. Nước clo từ từ mất màu vàng nhạt
C. Dung dịch có màu vàng
D. Dung dịch sau phản ứng làm quỳ hóa xanh
Lời giải:
Đáp án: B
Giải thích:
Nước Clo từ từ mất màu vàng nhạt
SO2 + Cl2+ 2H2O → 2HCl + H2SO4
Câu 7. Đổ dung dịch AgNO3 lần lượt vào 4 dung dịch: NaF, NaCl, NaBr và NaI thì thấy:
A. Cả 4 dung dịch đều tạo kết tủa.
B. Có 3 dung dịch tạo ra kết tủa và 1 dung dịch không tạo kết tủa.
C. Có 2 dung dịch tạo ra kết tủa và 2 dung dịch không tạo kết tủa.
D. Có 1 dung dịch tạo ra kết tủa và 3 dung dịch không tạo ra kết tủa.
Lời giải:
Đáp án: B
Giải thích:
AgCl, AgBr , AgI đều tạo kết tủa
Chỉ có AgF tan.
Câu 8. SO2 là một trong những khí gây ô nhiễm môi trường là do
A. SO2 là chất có mùi hắc, nặng hơn không khí.
B. SO2 vừa có tính khử, vừa có tính oxi hóa.
C. SO2 là khí độc, tan trong nước mưa tạo thành axit gây ra sự ăn mòn kim loại.
D. SO2 là một oxit axit.
Lời giải:
Đáp án: C
Giải thích:
SO2 là một trong những khí gây ô nhiễm môi trường là do SO2 là khí độc, tan trong nước mưa tạo thành axit gây ra sự ăn mòn kim loại.
Câu 9. SO2 vừa có tính oxi hóa, vừa có tính khử vì trong phân tử SO2
A. S có mức oxi hóa trung gian.
B. S có mức oxi hóa cao nhất.
C. S có mức oxi hóa thấp nhất.
D. S còn có một đôi electron tự do.
Lời giải:
Đáp án: A
Giải thích:
SO2 vừa có tính oxi hóa, vừa có tính khử vì trong phân tử SO2 thì S có mức oxi hóa trung gian.
Câu 10. Điều chế SO2 trong phòng thí nghiệm, chúng ta tiến hành như sau:
A. cho lưu huỳnh cháy trong không khí.
B. đốt cháy hoàn toàn khí H2S trong không khí.
C. cho dung dịch Na2SO3 tác dụng với H2SO4.
D. cho Na2SO3 tinh thể tác dụng với H2SO4 đặc, nóng.
Lời giải:
Đáp án: D
Giải thích:
Trong phòng thí nghiệm, SO2 được điều chế bằng cách đun nóng dung dịch axit H2SO4với muối Na2SO3 tinh thể
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑
Câu 11. Nhận định nào sau đây là sai?
A. S vừa có tính oxi hoá vừa có tính khử.
B. Hg phản ứng với S ngay nhiệt độ thường.
C. Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính oxi hóa.
D. Ở nhiệt độ cao, S tác dụng với nhiều kim loại và thể hiện tính oxi hoá.
Lời giải:
Đáp án: C
Câu 12. Lưu huỳnh tác dụng với axit sunfuric đặc, nóng: S + 2H2SO4→ 3SO2 + 2H2O. Trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị oxi hóa là
A. 1 : 2
B. 1 : 3
C. 3 : 1
D. 2 : 1
Lời giải:
Đáp án: D
Giải thích:
S + 2H2SO4→ 3SO2 + 2H2O
S là chất khử, H2SO4 là chất oxi hóa
=> tỉ lệ số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị oxi hóa là 2 : 1
Câu 13. Cho 4,48 lít khí SO2 (đktc) tác dụng với 300ml dd NaOH 1M. Tính khối lượng muối thu được?
A. 18,9 gam
B. 9,45 gam
C. 14,18 gam
D. 28,35 gam
Lời giải:
Đáp án: A
Giải thích:
nSO2 = 4,48/22,4 = 0,3 (mol)
nNaOH = 300*1/1000 = 0,3 (mol)
Phương trình phản ứng: 2NaOH + SO2 → Na2SO3 + H2O
Theo phương trình phản ứng: nNaOH = 2nSO2 → NaOH hết, SO2 dư. Lượng muối tính theo NaOH.
nNa2SO3 = nNaOH/2 = 0,15 (mol).
=>mNa2SO3 = 0,15. 126 = 18,9 (g)