H2S + NaOH → Na2S + H2O | H2S ra Na2S
Sinx.edu.vn xin giới thiệu phương trình H2S + NaOH → Na2S + H2O là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng H2S + NaOH → Na2S + H2O
1. Phương trình phản ứng H2S tác dụng NaOH
H2S + 2NaOH → Na2S + 2H2O
2. Điều kiện phản ứng xảy H2S ra Na2S
NaOH và H2S phản ứng với tỉ lệ 2:1 vừa đủ.
3. Cách thực hiện phản ứng
Dẫn khí H2S vào ống nghiệm chứa NaOH và vài giọt chất chỉ thị.
4. Hiện tượng nhận biết phản ứng
Quan sát sự chuyển màu của chỉ thị phù hợp trước và sau phản ứng.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của H2S (Hidro sunfua)
Dung dịch H2S có tính axit yếu ở 2 nấc nên khi tác dụng với dung dịch kiềm thì có thể tạo muối axit hoặc tạo muối trung hoà.
5.2. Bản chất của NaOH (Natri hidroxit)
NaOH là một bazo mạnh phản ứng với axit tạo thành muối và nước.
6. Dạng bài tập H2S tác dụng bazơ
NaOH + H2S → NaHS + H2O (1)
2NaOH + H2S → Na2S + 2H2O (2)
Lập tỉ lệ: T= nNaOH/nH2S
+) Nếu T< 1: hỗn hợp sau phản ứng gồm NaHS và NaOH dư, phương trình phản ứng (1).
+) Nếu T = 1: chỉ xảy ra phản ứng (1), NaOH và H2S phản ứng với tỉ lệ 1:1 vừa đủ.
+) Nếu 1 < T < 2: xảy ra cả phản ứng (1) và (2), cả NaOH và H2S đều hết phản ứng hết
+) Nếu T = 2: chỉ xảy ra phản ứng (2), NaOH và H2S phản ứng với tỉ lệ 2: 1 vừa đủ
+) Nếu T > 2: xảy ra phản ứng (2), hỗn hợp sau phản ứng gồm Na2S và NaOH dư
7. Tính chất hóa học của H2S
7.1. Tính axit yếu
Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên là axit sunfuhiđric (H2S).
Axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2- và muối axit như NaHS chứa ion HS−.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
7.2. Tính khử mạnh
Là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
Khi tham gia phản ứng hóa học, tùy thuộc vào bản chất và nồng độ của chất oxi hóa, nhiệt độ,...mà nguyên tố lưu huỳnh có số oxi hóa −2 (S-2) có thể bị oxi hóa thành (S0), (S+4), (S+6).
Tác dụng với oxi có thể tạo S hoặc SO2 tùy lượng ôxi và cách tiến hành phản ứng.
2H2S + 3O2 dư → 2H2O + 2SO2
2H2S + O2 → 2H2O + 2S
Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
Tác dụng với clo có thể tạo S hay H2SO4 tùy điều kiện phản ứng.
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
H2S + Cl2 → 2HCl + S (khí clo gặp khí H2S)
8. Ứng dụng của H2S
Hidro sunfua dùng để sản xuất lưu huỳnh và axit sunfuric dùng để sản xuất axit sunfuric, các chất trung gian sulfide vô cơ dùng làm nguyên liệu cho những bước tiếp theo của các quy trình sản xuất dược phẩm , thuốc nhuộm, thuốc trừ sâu…
Sản xuất nước nặng trong một số nhà máy điện hạt nhân cũng là một vai trò của nó .
Được con người dùng làm chất khử trùng trong nông nghiệp.
Khí này còn được trong một số loại dầu cắt, chất làm mát và chất bôi trơn,…
9. Tính chất hoá học của NaOH
NaOH Là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
10. Bạn có biết
- NaOH phản ứng với H2S tùy theo tỉ lệ về số mol mà sản phẩm thu được có thể là muối sunfua trung hòa hoặc muối axit hoặc hỗn hợp cả hai muối.
- NaOH phản ứng với H2S chỉ thu được muối Na2S khi T = 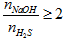
11. Bài tập vận dụng
Câu 1. Tính chất nào dưới đây là tính chất đặc trưng của khí hiđro sunfua?
A. Là chất khí không màu.
B. Là chất khí độc.
C. Là chất khí có mùi trứng thối.
D. Cả 3 phương án trên đều đúng.
Lời giải:
Đáp án: D
Câu 2. Khẳng định nào sau đây là đúng khi nói về tính chất hóa học của hiđro sunfua.
A. Tính axit mạnh và tính khử yếu.
B. Tính bazơ yếu và tính oxi hóa mạnh.
C. Tính bazơ yếu và tính oxi hóa yếu.
D. Tính axit yếu và tính khử mạnh.
Lời giải:
Đáp án: D
Giải thích:
Tính chất hóa học của hiđro sunfua: Tính axit yếu và tính khử mạnh.
Câu 3. Khẳng định nào sau đây là đúng khi nói về tính chất hóa học của hiđro sunfua.
A. Tính axit mạnh và tính khử yếu.
B. Tính bazơ yếu và tính oxi hóa mạnh.
C. Tính bazơ yếu và tính oxi hóa yếu.
D. Tính axit yếu và tính khử mạnh.
Lời giải:
Đáp án: D
Câu 4. Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ:
A. Có phản ứng oxi hoá - khử xảy ra.
B. Có kết tủa CuS tạo thành, không tan trong axit mạnh.
C. Axit sunfuhiđric mạnh hơn axit sunfuric.
D. Axit sunfuric mạnh hơn axit sunfuhiđric.
Lời giải:
Đáp án: B
Giải thích:
H2S + CuSO4 → CuS↓ (kết tủa đen) + H2SO4
=> Có kết tủa CuS tạo thành, không tan trong axit mạnh.
Câu 5. Thực hiện các thí nghiệm sau ở điều kiện thường:
(a) Sục khí H2S vào dung dịch NaOH.
(b) Cho kim loại Na vào nước.
(c) Sục khí Cl2 vào dung dịch Ca(OH)2.
(d) Cho NH4Cl vào dung dịch NaOH.
(e) Cho bột Zn vào dung dịch HNO3.
Số thí nghiệm xảy ra phản ứng oxi hóa – khử là
A. 3.
B. 4.
C. 2.
D. 5.
Lời giải:
Đáp án: A
Câu 6. Có các lọ đựng hóa chất riêng rẽ: Na2S, NaCl, AgNO3, Na2CO3. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó ?
A. dung dịch NaOH.
B. dung dịch H2SO4.
C. dung dịch HCl.
D. phenolphtalein.
Lời giải:
Đáp án: C
Câu 7. Để phân biệt khí H2S với khí CO2người ta sử dụng thuốc thử nào sau đây dùng
A. dung dịch HCl
B. dung dịch Pb(NO3)2
C. dung dịch Na2SO4
D. dung dịch NaOH
Lời giải:
Đáp án: B
Câu 8. Dẫn 2,24 lit (đktc) khí hiđrosunfua vào 300 ml dung dịch NaOH 1M. Sau phản ứng thu được muối là
A. Na2S, NaOH dư
B. NaHS
C. NaHS, Na2S
D. NaHS, NaOH dư
Lời giải:
Đáp án: A
Câu 9. Dẫn 3,36 lít khí H2S (đktc) vào 200ml dung dịch KOH 2M, sau khi phản ứng hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được m gam rắn khan. Giá trị của m là:
A. 16,5.
B. 27,5.
C. 22,1.
D. 27,7.
Lời giải:
Đáp án: D
Giải thích:
nH2S = 0,15 mol; nKOH = 0,5 mol
Đặt T = nKOH/nH2S= 0,5/0,15 =3,33 > 2
Tạo muối K2S
2KOH + H2S → K2S + 2H2O
0,3 ← 0,15 → 0,15
Chất rắn khan gồm K2S 0,15 mol và KOH dư 0,2 mol
m = 0,15. 110 + 0,2. 56 = 27,7 gam
Câu 10. Dẫn 2,24 lít (đktc) khí hiđrosunfua vào 250 ml dung dịch NaOH 1M. Tính khối lượng muối sau phản ứng.
A. 7,8 gam
B. 3,9 gam
C. 2 gam
D. 4 gam
Lời giải:
Đáp án: A
Giải thích:
nH2S = 2,24/22,4 = 0,1 (mol)
nNaOH= VNaOH×CM = 0,25×1 = 0,25 (mol)
Xét tỉ lệ ta có
T = nNaOH/nH2S = 0,25/0,1 = 2,5 > 2, phản ứng tạo thành Na2S và NaOH dư. Mọi tính toán theo H2S
H2S + 2NaOH → Na2S + 2H2O
(mol) 0,1 → 0,2 → 0,1
Ta có: mNaOHdu= (0,25 − 0,2).40 = 2(g); mNa2S= 0,1.78 = 7,8 (g)