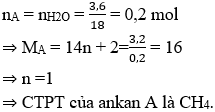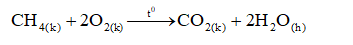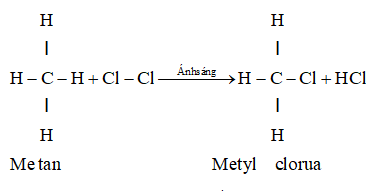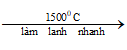CH4 ra HCHO l CH4 + O2 → HCHO + H2O | Metan ra Andehit fomic
Sinx.edu.vn xin giới thiệu phương trình CH4 + O2 → HCHO + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Nội dung bài viết
Xem thêm »
Phản ứng CH4 + O2 HCHO + H2O
1. Phương trình phản ứng Metan ra andehit fomic
CH4 + O2 HCHO + H2O
2. Bản chất của các chất tham gia phản ứng
2.1. Bản chất của CH4 (Metan)
Trong phản ứng trên CH4 là chất khử.
2.2. Bản chất của O2 (Oxi)
Trong phản ứng trên O2 là chất oxi hoá.
3. Điều kiện phản ứng xảy ra
Nhiệt độ: 600°C
Xúc tác: NO
4. Cách thực hiện phản ứng
- khi có xúc tác, nhiệt độ thích hợp khí metan (CH4) sẽ bị oxi hóa không hoàn toàn tạo thành dẫn xuất chứa oxi và nước
5. Tính chất hóa học của CH4
5.1. Tác dụng với oxi
- Metan cháy tạo thành khí cacbon đioxit và hơi nước.
- Phản ứng trên tỏa nhiều nhiệt. Hỗn hợp gồm một thể tích metan và hai thể tích oxi là hỗn hợp nổ mạnh.
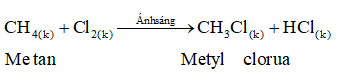
5.2. Tác dụng với clo
- Metan tác dụng với clo khi có ánh sáng.
Viết gọn:
- Phản ứng trên, nguyên tử hidro của metan được thay thế bởi nguyên tử clo. Vì vậy phản ứng trên được gọi là phản ứng thế.
5.3. Phản ứng nhiệt phân
2CH4 C2H2 + H2
6.Tính chất vật lí của Metan
Metan là chất khí không màu không mùi không vị. Chúng rất độc và dễ bắt cháy, tạo ra lửa màu xanh.
CH4 hóa lỏng khi ở nhiệt độ - 162 °C, hóa rắn ở nhiệt độ - 183 °C.
Điểm bốc cháy là 537 °C .
Khối lượng riêng của metan là 0,717 kg / m3 .
Metan không có khả năng hòa tan trong các dung môi phân cực vì không có sự liên kết giữa các hidro, chúng chỉ tan trong dung môi không phân cưc.
Metan không có tính dẫn điện.
7. Hiện tượng nhận biết phản ứng
- Trước khi có xúc tác, nhiệt độ thích hợp thì hỗn hợp phản ứng là chất khí không màu. Sau khi có xúc tác, nhiệt độ thích hợp thì hỗn hợp sản phẩm thu được là chất lỏng không màu.
8. Bạn có biết
- Phản ứng trên được gọi là phản ứng oxi hóa khử
- Tương tự metan (CH4) các đồng đẳng của metan cũng tham gia phản ứng đốt cháy tương tự.
9. Ứng dụng của phản ứng CH4 + O2 → H2O + HCHO
Phản ứng hóa học giữa khí methane (CH4) và khí oxi (O2), tạo ra nước (H2O) và formaldehyde (HCHO), đóng vai trò quan trọng và có ứng dụng đa dạng trong đời sống và công nghiệp. Dưới đây là một số ví dụ cụ thể về ứng dụng của phản ứng này:
9.1. Sản xuất formaldehyde
Phản ứng CH4 + O2 → H2O + HCHO là quy trình cơ bản để sản xuất formaldehyde. Formaldehyde là một hợp chất quan trọng trong việc sản xuất nhiều sản phẩm khác nhau, bao gồm nhựa urea-formaldehyde, loại vật liệu được sử dụng rộng rãi trong sản xuất đồ nội thất, vật liệu xây dựng và các sản phẩm khác. Hơn nữa, formaldehyde còn đóng vai trò trong sản xuất chất tẩy rửa, chất khử trùng và nhiều sản phẩm khác.
9.2. Nhiên liệu và năng lượng
CH4, là một nguồn nhiên liệu sạch và dễ kiếm, có thể được sử dụng để tạo ra nhiệt và năng lượng thông qua phản ứng CH4 + O2 → H2O + HCHO. Quá trình này có thể áp dụng trong các hệ thống điện sinh khối và hệ thống điện mặt trời. Đồng thời, phản ứng này cũng được ứng dụng để sản xuất khí đốt, một nguồn năng lượng quan trọng trong ngành công nghiệp điện.
9.3. Ứng dụng trong y học
Formaldehyde được sử dụng trong lĩnh vực y học làm chất bảo quản cho các mẫu mô và các mẫu sinh học khác. Nó còn được ứng dụng để tạo ra các chất kháng khuẩn và sản phẩm kháng nấm. Ngoài ra, formaldehyde còn đóng vai trò trong sản xuất mỹ phẩm, chất tẩy rửa và các sản phẩm khác, đóng góp vào nhiều lĩnh vực của ngành y tế và làm đẹp.
9.4. Ứng dụng trong sản xuất thực phẩm
Sử dụng formaldehyde như một chất bảo quản trong sản xuất thực phẩm là để ngăn chặn sự phát triển của vi khuẩn và nấm. Phản ứng CH4 + O2 → H2O + HCHO cũng được ứng dụng để tạo ra các chất bảo quản khác, như benzoic acid và sorbic acid, giúp nâng cao khả năng bảo quản và kéo dài thời hạn lưu trữ của sản phẩm thực phẩm.
9.5. Ứng dụng trong sản xuất dược phẩm
Formaldehyde chơi một vai trò quan trọng trong việc sản xuất nhiều loại dược phẩm, bao gồm cả các loại thuốc kháng sinh và thuốc chống ung thư. Nó cũng được sử dụng để sản xuất các chất bảo quản và chất hoạt động cho các sản phẩm dược phẩm khác, giúp duy trì tính chất và độ ổn định của các thành phần trong các sản phẩm y tế.
Các ứng dụng trên chỉ là một số ví dụ cụ thể về việc áp dụng phản ứng CH4 + O2 → H2O + HCHO. Tùy thuộc vào nhu cầu sử dụng của người tiêu dùng, phản ứng này còn có thể được áp dụng trong nhiều lĩnh vực khác nhau như sản xuất giấy, sản xuất xà phòng, sản xuất sơn và các vật liệu xây dựng khác, thể hiện sự linh hoạt và đa dạng của ứng dụng trong ngành công nghiệp và đời sống hàng ngày.
10. Bài tập
Câu 1: Cho các phát biểu về anđehit:
(a) Anđehit là hợp chất chỉ có tính khử.
(b) Anđehit cộng hidro tạo thành ancol bậc một.
(c) Tất cả các anđehit tác dụng với dung dịch AgNO3/NH3 đun nóng đều sinh ra Ag.
(d) Anđehit no, đơn chức có công thức tổng quát là CnH2nO.
(e) Anđehit no không tham gia phản ứng cộng.
Số phát biểu đúng là
A. 2
B. 4
C. 5
D. 3
Lời giải:
Đáp án: A
Giải thích:
(a) sai, anđehit là hợp chất vừa có tính oxi hóa và tính khử.
(b) đúng
(c) đúng
(d) sai, vì Anđehit no, đơn chức, mạch hở có công thức tổng quát là CnH2nO
(e) sai, anđehit no vẫn có phản ứng cộng vào nhóm -CHO
Vậy có 2 phát biểu đúng
Câu 2: Anđehit axetic không tác dụng được với
A. Na.
B. H2.
C. O2.
D. dung dịch AgNO3/NH3.
Lời giải:
Đáp án: A
Câu 3: Các đồng phân anđehit của C5H10O là
A. 2.
B. 3.
C. 4.
D. 5.
Lời giải:
Đáp án: C
Câu 4: Phát biểu nào sau được dùng để định nghĩa công thức đơn giản nhất của hợp chất hữu cơ?
A. Công thức đơn giản nhất là công thức biểu thị số nguyên tử của mỗi nguyên tố trong phân tử.
B. Công thức đơn giản nhất là công thức biểu thị tỉ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử.
C. Công thức đơn giản nhất là công thức biểu thị tỉ lệ phần trăm số mol của mỗi nguyên tố trong phân tử.
D. Công thức đơn giản nhất là công thức biểu thị tỉ lệ số nguyên tử C và H có trong phân tử.
Lời giải:
Đáp án: B
Câu 5: Ứng dụng nào sau đây không phải của anđehit fomic
A. Dùng để sản xuất nhựa phenol-fomanđehit.
B. Dùng để sản xuất nhựa ure-fomanđehit.
C . Dùng để tẩy uế, ngâm mẫu động vật.
D. Dùng để sản xuất axit axetic.
Lời giải:
Đáp án: D
Câu 6. Phản ứng nào sau đây không tạo anđehit axetic?
A. Cho axetilen phản ứng với nước.
B. Oxi hóa không hoàn toàn etilen.
C. Oxi hóa không hoàn toàn ancol etylic.
D. Oxi hóa không hoàn toàn ancol metylic.
Lời giải:
Đáp án: D
Câu 7. Butan có lẫn tạp chất và các khí etilen, cacbonic, axetilen. Nêu lần lượt cách tiến hành và viết các phương trình phản ứng xảy ra trong quá trình làm sạch khí.
A. Dung dịch brom dư, dung dịch nước vôi trong dư.
B. Dung dịch nước vôi trong dư.
C. H2SO4 đặc, nhệt độ
D. Khí hiđro.
Lời giải:
Đáp án: A
Giải thích:
Cho hỗn hợp khí C4H10, C2H4, C2H2, CO2 đi qua dung dịch brom dư. Khí đi ra là C4H10 và CO2, cho hỗn hợp thu được vào dung dịch nước vôi trong dư. Khí đi ra là C4H10 nguyên chất.
C2H4 + Br2 → C2H4Br2
C2H2 + 2Br2→ C2H2Br4
CO2 + Ca(OH)2→ CaCO3+ H2O
Câu 8: Chọn đúng sản phẩm của phản ứng sau : CH4 + O2 → (điều kiện: nhiệt độ,xúc tác thích hợp).
A. CO2, H2O
B. CO, H2O
C. HCHO, H2O
D. C, H2O
Lời giải:
Chọn C.
Khi có nhiệt độ xúc tác thích hợp thì khí metan sẽ bị oxi hóa không hoàn toàn tạo ra dẫn xuất chứa oxi và nước.
Câu 9: Điều kiện của phản ứng giữa khí metan(CH4) với khí oxi trong không khí (metan bị oxi không hoàn toàn):
A. Có ánh sáng
B. Có NO làm xúc tác
C. Có nhiệt độ thích hợp
D. Cả B và C đều đúng
Lời giải:
Chọn D.
Khi có nhiệt độ xúc tác thích hợp thì khí metan sẽ bị oxi hóa không hoàn toàn tạo ra dẫn xuất chứa oxi và nước
Câu 10: Oxi hóa không hoàn toàn 3,2g một ankan A thì thu được 3,6 g nước và dẫn xuất chứa oxi của ankan đó. Tìm CTPT của ankan A.
A. CH4
B. C2H6
C. C3H8
D. C4H10
Lời giải:
Chọn A.