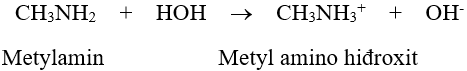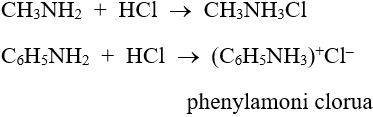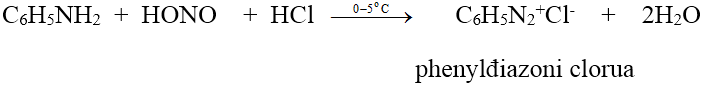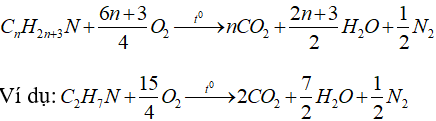C6H5NH2 + HCl → C6H5NH3Cl | C6H5NH2 ra C6H5NH3Cl
Sinx.edu.vn xin giới thiệu phương trình C6H5NH2 + HCl → C6H5NH3Cl là phản ứng hóa hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng C6H5NH2 + HCl → C6H5NH3Cl
1. Phương trình phản ứng hóa học
C6H5NH2 + HCl → [C6H5NH3]+Cl-
Anilin phenylamoni clorua
Mởi rộng: Phương trình tổng quát amin tác dụng với dung dịch axit HCl
R–NH2 + HCl → R–NH3Cl
2. Điều kiện phản ứng
Nhiệt độ thường
3. Cách thực hiện phản ứng
Cho anilin vào ống nghiệm đựng dung dịch HCl.
4. Hiện tượng nhận biết phản ứng
Anilin tan.
5. Bản chất của C6H5NH2 (Anilin) trong phản ứng
Do nguyên tử N trong amin ở trạng thái lai hóa sp3 trên N vẫn còn cặp e tự do chưa liên kết, có thể nhận proton theo thuyết Bronstet nên amin có tính bazơ tác dụng được với axit.
6. Tính chất hóa học của Amin
6.1. Tính bazơ
Do nguyên tử N trong phân tử amin còn cặp e chưa sử dụng có khả năng nhận proton.
* So sánh tính bazơ của các amin:
+ Nếu nguyên tử N trong phân tử amin được gắn với gốc đẩy e (gốc no: ankyl) thì tính bazơ của amin mạnh hơn so với tính bazơ của NH3. Những amin này làm cho quỳ tím chuyển thành màu xanh.
+ Nếu nguyên tử N trong phân tử amin gắn với các gốc hút e (gốc không no, gốc thơm) thì tính bazơ của amin yếu hơn so với tính bazơ của NH3. Những amin này không làm xanh quỳ tím.
+ Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.
⇒ Lực bazơ: CnH2n + 1–NH2 > H–NH2 > C6H5–NH2
- Dung dịch metylamin và nhiều đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein.
– Amin bậc III mà gốc hiđrocacbon R, R’ và R’’ có số C ≥ 2 thì các gốc R, R’ và R’’ cản trở amin nhận proton H+ ⇒ tính bazơ yếu ⇒ dung dịch không làm đổi màu quỳ tím và phenolphtalein.
- Anilin và các amin thơm rất ít tan trong nước. Dung dịch của chúng không làm đổ màu quỳ tím và phenolphtalein.
- Tác dụng với axit: R–NH2 + HCl → R–NH3Cl
Ví dụ:
- Tác dụng dung dịch muối của các kim loại có hiđroxit kết tủa:
Ví dụ: 3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3↓ + 3CH3NH3Cl
- Lưu ý: Khi cho muối của Cu2+, Zn2+, … vào dung dịch amin (dư) → hiđroxit kết tủa → kết tủa tan (tạo phức chất).
6.2. Phản ứng với axit nitrơ HNO2
- Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ.
C2H5NH2 + HONO → C2H5OH + N2↑ + H2O
- Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 - 5oC) cho muối điazoni:
6.3. Phản ứng ankyl hóa
Amin bậc một hoặc bậc hai tác dụng với ankyl halogenua (CH3I, …) , nguyên tử H của nhóm amin có thể bị thay thế bởi gốc ankyl:
Ví dụ: C2H5NH2 + CH3I → C2H5NHCH3 + HI
– Phản ứng này dùng để điều chế amin bậc cao từ amin bậc thấp hơn.
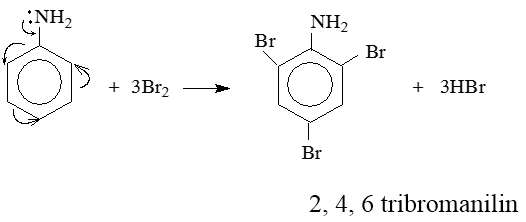
6.4. Phản ứng thế ở nhân thơm của anilin
Do ảnh hưởng của nhóm NH2 (tương tự nhóm –OH ở phenol), ba nguyên tử H ở các vị trí ortho và para so với nhóm –NH2 trong nhân thơm của anilin bị thay thế bởi ba nguyên tử brom:
Lưu ý: Phản ứng tạo ra kết tủa trắng 2, 4, 6 tribromanilin dùng nhận biết anilin.
6.5. Phản ứng cháy của amin no đơn chức mạch hở
7. Tính chất vật lí và nhận biết amin
- Metyl–, đimetyl–, trimetyl– và etylamin là những chất khí có mùi khai khó chịu, độc, dễ tan trong nước, các amin đồng đẳng cao hơn là chất lỏng hoặc rắn.
- Anilin là chất lỏng, nhiệt độ sôi là 184°C, không màu, rất độc, ít tan trong nước, tan trong ancol và benzen.
8. Tính chất hóa học của HCl
- Axit HCl làm đổi màu quỳ tím: Khi nhúng quỳ tím vào dung dịch axit sẽ có hiện tượng quỳ tím chuyển đỏ.
- Axit clohidric tác dụng với kim loại đứng trước H, tạo thành muối và hidro
Fe + 2HCl → FeCl2 + H2↑
- Axit clohidric tác dụng với oxit kim loại, tạo thành muối Clorua và nước
6HCl + Al2O3 →2AlCl3 + 3H2O
- Axit clohidric tác dụng với Bazơ, tạo thành muối Clorua và nước
3HCl + Al(OH)3 → AlCl3 + 3H2O
- Axit clohidric tác dụng với muối, tạo thành muối mới và axit mới
AgNO3 + 2HCl → AgCl↓ + HNO3
- Axit clohidric tác dụng với hợp chất có tính oxi hoá, thể hiện tính khử
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
Lưu ý: Axit HCl sẽ không tác dụng với những kim loại đứng sau H trong dãy điện hoá, không tác dụng với các phi kim, axit, oxit kim loại, oxit phi kim.
9. Bạn có biết
- Phản ứng trên cho thấy anilin có tính bazo.
- Các amin khác cũng có phản ứng với axit HCl tương tự anilin.
- Người ta vận dụng tính chất này để tách riêng anilin khỏi các chất hữu cơ.
10. Bài tập vận dụng
Câu 1. Dãy gồm các chất đều làm giấy quì tím ẩm chuyển sang màu xanh là:
A. anilin, metyl amin, amoniac.
B. amoni clorua metylamin natri hiđroxit.
C. anilin amoniac natri hiđroxit.
D. metylamin, amoniac, natri axetat.
Lời giải:
Đáp án: C
Câu 2. Để phân biệt anilin và etylamin đựng trong 2 lọ riêng biệt, ta dùng thuốc thử nào sau đây?
A. Dung dịch Br2
B. Dung dịch HCl
C. Dung dịch NaOH
D. Dung dịch AgNO3
Lời giải:
Đáp án: A
Câu 3. Công thức chung của amin no đơn chức, mạch hở là:
A. CnH2n+1N
B. CnH2n+1NH2
C. CnH2n+3N
D. CxHyN
Lời giải:
Đáp án: C
Câu 4. Số đồng phân amin bậc II của C4H11N là:
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án: D
Câu 5. Khi cho etylamin vào dung dịch FeCl3, hiện tượng nào xảy ra có:
A. khí bay ra
B. kết tủa màu đỏ nâu
C. khí mùi khai bay ra
D. Không hiện tượng gì.
Lời giải:
Đáp án: B