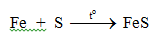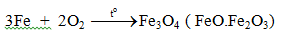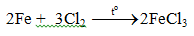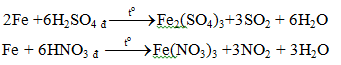Fe + CuSO4 → FeSO4 + Cu | Fe ra FeSO4
Sinx. edu.vn xin giới thiệu phương trình Fe + CuSO4 → FeSO4 + Cu là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Fe + CuSO4 → FeSO4 + Cu
1. Phương trình phản ứng Fe tác dụng CuSO4
Fe + CuSO4 → FeSO4 + Cu
2. Điều kiện phản ứng Fe tác dụng CuSO4
Nhiệt độ thường
Lưu ý: Kim loại tác dụng với muối phải là kim loại đứng trước trong dãy hoạt động hóa học, kim loại mạnh sẽ đẩy kim loại yếu ra khỏi dung dịch của chúng. Trừ nhóm kim loại kiềm, kiềm thổ (Ca, Ba,...)
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của Fe (Sắt)
- Trong phản ứng trên Fe là chất khử.
- Fe đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng.
3.2. Bản chất của CuSO4 (Đồng sunfat)
Trong phản ứng trên CuSO4 là chất oxi hoá.
4. Tính chất hoá học của Fe
Sắt là kim loại có tính khử trung bình, tùy theo các chất oxi hóa mà sắt có thể bị oxi hóa lên mức +2 hay +3.
Fe → Fe2+ + 2e
Fe → Fe3+ + 3e
4.1. Tác dụng với phi kim
a. Tác dụng với lưu huỳnh
b. Tác dụng với oxi
c. Tác dụng với clo
4.2. Tác dụng với axit
a.Tác dụng với dung dịch axit HCl, H2SO4 loãng
Fe + 2H+ → Fe2+ + H2
b. Với các axit HNO3, H2SO4 đặc
Fe + 4HNO3 l → Fe(NO3)3 + NO + 2H2O
Chú ý: Với HNO3 đặc, nguội; H2SO4 đặc, nguội: Fe bị thụ động hóa.
4.3. Tác dụng với dung dịch muối
- Fe đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
Fe+ CuSO4 → FeSO4 + Cu
Chú ý:
Fe + 2Ag+ → Fe2+ + 2Ag
Ag+ dư + Fe2+ → Fe3+ + Ag
4.4. Ứng dụng của Fe
- Sắt có trong những đồ dùng cá nhân như: dao, kềm, kéo, kệ sắt, các loại dụng cụ gia đình khác,…
- Sắt ở trong các đồ nội thất như: bàn ghế, khung cửa, tủ kệ, cầu thang,…
- Các loại máy móc trong gia đình như máy xay, máy giặt, bồn rửa cũng có sắt.
- Trong giao thông vận tải sắt cũng đóng vai trò rất quan trọng.
- Sắt là bộ khung sườn cho những công trình xây dựng như nhà cửa, cầu, tòa nhà,…
5. Mở rộng kiến thức về CuSO4
5.1. Tính chất vật lí và nhận biết
Tính chất vật lí:
- Đồng (II) sulfat CuSO4 là chất bột màu trắng, hút mạnh hơi ẩm của không khí để tạo thành hiđrat CuSO4.5H2O màu lam. Lợi dụng tính chất này, người ta dùng CuSO4 khan để phát hiện nước ở lẫn trong hợp chất hữu cơ.
- Tan tốt trong nước.
Nhận biết: Khi có mặt nước, CuSO4 tan dần, chuyển từ chất bột màu trắng sang dung dịch có màu xanh.
5.2. Tính chất hoá học
Có tính chất hóa học của muối.
a) Tác dụng với dung dịch bazo:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
CuSO4 + Ba(OH)2 → Cu(OH)2 + BaSO4
b) Tác dụng với muối:
BaCl2 + CuSO4 → CuCl2 + BaSO4
5.3. Điều chế
- Cho đồng (II) oxit tác dụng với H2SO4
CuO + H2SO4 → CuSO4 + H2
- Cho đồng phản ứng với H4SO4 đặc nóng
Cu + 2H2SO4 
6. Bài tập vận dụng liên quan
Câu 1. Để làm sạch dung dịch đồng nitrat Cu(NO3)2 có lẫn tạp chất bạc nitrat AgNO3. Ta dùng kim loại:
A. Ag
B. Cu.
C. Fe.
D. Au.
Lời giải:
Đáp án: B
Câu 2. Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng:
A. Quỳ tím và nước
B. Dung dịch Ca(NO3)2
C. Dung dịch AgNO3
D. Dung dịch NaOH
Lời giải:
Đáp án: D
Câu 3. Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu.
Trong phản ứng trên xảy ra
A. Sự oxi hóa Fe và sự oxi hóa Cu.
B. sự khử Fe2+ và sự oxi háo Cu.
C. sự oxi hóa Fe và sự khử Cu2+.
D. sự khử Fe2+ và sự khử Cu2+.
Lời giải:
Đáp án: C
Câu 4. Cho m gam Fe tác dụng hết với dung dịch CuSO4 dư, thu được 12,8 gam Cu. Giá trị của m là
A. 22,4.
B. 12,6.
C. 16,8.
D. 11,2
Lời giải:
Đáp án: D
nCu = 0,2 mol
PTHH: CuSO4 + Fe → FeSO4 + Cu
0,2 ← 0,2 mol
⟹ mFe = 0,2.56 = 11,2 gam