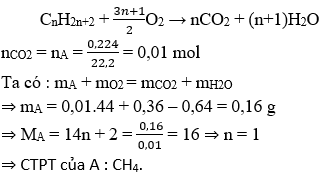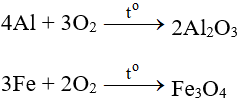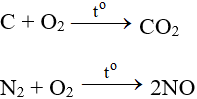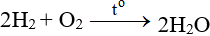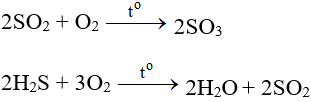CH4 ra CO2 | CH4 + O2 → CO2 + H2O l Metan ra Cacbonic
Sinx.edu.vn xin giới thiệu phương trình CH4 + O2 → CO2 + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Nội dung bài viết
Xem thêm »
Phản ứng CH4 + O2 CO2 + H2O
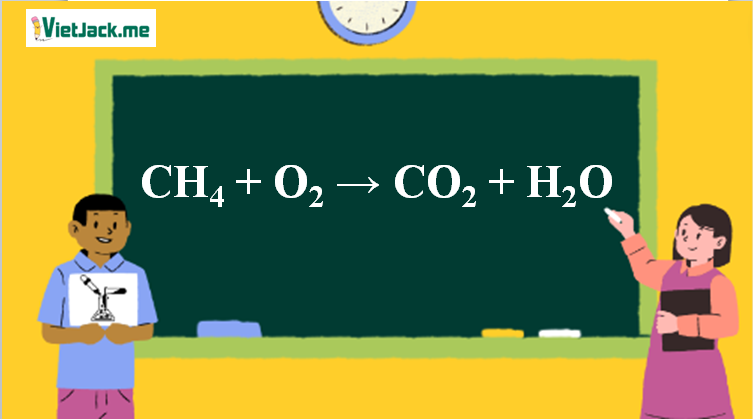
1. Phương trình phản ứng CH4 ra CO2
CH4 + O2 CO2 + H2O
2. Bản chất của các chất tham gia phản ứng
Đây là phản ứng đốt cháy khí Metan trong không khí.
3. Điều kiện phản ứng đốt cháy metan xảy ra
Điều kiện: Nhiệt độ
4. Cách thực hiện phản ứng kim loại Ca với H2O
Đốt cháy hoàn toàn khí metan (CH4) trong không khí thì thu được khí cacbonic và nước.
5. Tính chất hóa học
5.1. Tính chất hóa học của Metan
Metan có thể tham gia vào một số phản ứng hóa học như sau:
a. Tham gia phản ứng thế với halogen clo, brom
Metan phản ứng với Halogen cho ra dẫn xuất halogen và hidro halogenua.Ví dụ đối với Cl:
CH4+ Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
b. Phản ứng với hơi nước tạo ra khí CO
CH4 + H2O = CO + H2O
(Điều kiện phản ứng: Nhiệt độ 1000, Chất xúc tác Ni).
c. Phản ứng cháy với oxi
Phản ứng cháy hoàn toàn:
CH4 + 2O2→ CO2+ 2H2O
Phản ứng cháy không hoàn toàn: Được dùng trong sản xuất fomanđehit, bột than, khí đốt,…
(đốt trong điều kiện thiếu không khí)
d. Phản ứng phân hủy tạo ra axetilen
Metan bị nhiệt phân bằng cách nung nóng nhanh metan với một lượng nhỏ oxi ở nhiệt độ khoảng 1500oC (ΔH = 397kJ/mol)
Oxi được dùng để đốt cháy 1 phần metan, cung cấp thêm nhiệt cho phản ứng.
5.2. Tính chất vật lí của Metan
Metan là chất khí không màu không mùi không vị. Chúng rất độc và dễ bắt cháy, tạo ra lửa màu xanh.
CH4 hóa lỏng khi ở nhiệt độ - 162 °C, hóa rắn ở nhiệt độ - 183 °C.
Điểm bốc cháy là 537 °C .
Khối lượng riêng của metan là 0,717 kg / m3 .
Metan không có khả năng hòa tan trong các dung môi phân cực vì không có sự liên kết giữa các hidro, chúng chỉ tan trong dung môi không phân cưc.
Metan không có tính dẫn điện.
6. Tính chất hóa học của Oxi (O2)
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
6.1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
6.2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
6.3. Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
7. Bạn có biết
- Phản ứng trên được gọi là phản ứng đốt cháy
- Tương tự metan (CH4) các đồng đẳng của metan cũng tham gia phản ứng đốt cháy tương tự.
- Nếu thiếu oxi, phản ứng cháy của ankan xảy ra không hoàn toàn: sản phẩm cháy ngoài CO2, H2O còn có C, CO...
- Khi đốt cháy ankan, số mol H2O thu được sau phản ứng luôn lớn hơn số mol CO2.
8.Hiện tượng nhận biết phản ứng CH4 tác dụng với Oxi
Phản ứng tạo khí làm đục nước vôi trong.
9. Ứng dụng
Phản ứng hoá học CH4 + 2O2 → CO2 + 2H2O là phản ứng đốt cháy metan (CH4) trong không khí, và nó có rất nhiều ứng dụng quan trọng, bao gồm:
- Năng lượng: Phản ứng cháy metan là một nguồn cung cấp nhiệt lớn và được sử dụng rộng rãi trong lĩnh vực nhiệt động học. Metan được sử dụng làm nhiên liệu trong các ứng dụng như lò hấp nước, lò sưởi, lò nướng, và các nhà máy điện sinh nhiệt. Nó cung cấp nhiệt độ cao và sạch, tạo ra CO2 và nước là các sản phẩm cuối cùng.
- Sản xuất nhiên liệu đốt động cơ: Metan cũng được sử dụng làm nhiên liệu cho động cơ đốt trong, chẳng hạn như động cơ xe ô tô chạy bằng khí tự nhiên nén (CNG) hoặc động cơ biến chất để tạo thành khí tự nhiên nén (LNG). Điều này giúp giảm phát thải khí nhà kính và lưu lượng hạt bụi.
- Sản xuất nhiên liệu hóa lỏng: Metan có thể được nén và làm lỏng để tạo ra khí tự nhiên nén (CNG) hoặc khí tự nhiên lỏng (LNG) để sử dụng trong ngành vận tải và công nghiệp. CNG và LNG được xem là nhiên liệu sạch hơn và thân thiện với môi trường so với xăng và dầu diesel.
- Sản xuất nhiên liệu hóa học: Metan cũng được sử dụng làm nguồn nguyên liệu để sản xuất nhiều hợp chất hóa học khác, chẳng hạn như metanol, etylen, và nhiều sản phẩm hữu cơ khác.
- Nông nghiệp: Metan có thể được sản xuất trong quá trình phân giải chất hữu cơ trong động vật và dùng để làm nhiên liệu nông nghiệp hoặc làm nguồn năng lượng cho các ứng dụng nông nghiệp.
Phản ứng cháy metan là một trong những phản ứng hoá học quan trọng và phổ biến trong cuộc sống hàng ngày, đóng vai trò quan trọng trong cung cấp nhiệt động lượng và nhiên liệu cho nhiều ứng dụng khác nhau
10. Bài tập
Câu 1: Trong phòng thí nghiệm có thể thu khí CH4 bằng cách:
A. Đẩy không khí (ngửa bình)
B. Đẩy axit
C. Đẩy nước (úp bình)
D. Đẩy bazo
Lời giải:
Đáp án: C
Câu 2: Các tính chất vật lí cơ bản của metan là:
A. Chất lỏng, không màu, tan nhiều tron nước
B. Chất khí, không màu, không mùi, nhẹ hơn không khí, tan ít trong nước
C. Chất khí không màu, tan nhiều trong nước
D. Chất khí không màu, không mùi, nặng hơn không khí, tan ít trong nước
Đáp án: B
Giải thích: Các tính chất vật lí cơ bản của metan là: Chất khí, không màu, không mùi, nhẹ hơn không khí, tan ít trong nước
Câu 3: Phản ứng hóa học đặc trưng của metan là:
A. Phản ứng thế.
B. Phản ứng cộng.
C. Phản ứng oxi hóa – khử.
D. Phản ứng phân hủy.
Lời giải:
Đáp án: A
Câu 4: Điều kiện để phản ứng giữa Metan và Clo xảy ra là:
A. Có bột sắt làm xúc tác
B. Có axit làm xúc tác
C. Có nhiệt độ
D. Có ánh sáng
Lời giải:
Đáp án: D
Câu 5: Những phát biểu nào sau đây không đúng?
1) Metan tác dụng với clo khi có ánh sáng.
2) Metan là chất khí, không màu, không mùi, nặng hơn không khí.
3) Metan cháy tỏa nhiều nhiệt nên được dùng làm nhiên liệu trong đời sống và trong sản xuất.
4) Hỗn hợp giữa metan và clo là hỗn hợp nổ.
5) Trong phân tử metan có bốn liên kết đơn C-H.
6) Metan tác dụng với clo ở điều kiện thường.
A. 1, 3, 5.
B. 1, 2, 6.
C. 2, 4, 6.
D. 2, 4, 5.
Lời giải:
Đáp án: C
Giải thích:
Các phát biểu không đúng: 2, 4, 6
2) Metan là chất khí, không màu, không mùi, nặng hơn không khí => Sai, khí metan nhẹ hơn không khí.
4) Hỗn hợp giữa Metan và Clo là hỗn hợp nổ => Sai.
6) Metan tác dụng với Clo ở điều kiện thường => Sai, phải có chiếu sáng thì phản ứng mới xảy ra.
Câu 6: Để chứng minh sản phẩm của phản ứng cháy giữa metan và oxi có tạo thành khí cacbonic hay không ta cho vào ống nghiệm hóa chất nào say đây?
A. Nước cất
B. Nước vôi trong
C. Nước muối
D. Thuốc tím
Lời giải:
Đáp án: B
Câu 7: Đốt cháy hoàn toàn 2,24 lít khí metan (CH4) thì thu được khí CO2 và H2O. Tính thể tích khí CO2 sinh ra. Biết thể tích các khí đều đo ở đktc.
A. 1,12 l
B. 2,24 l
C. 4,48 l
D. 6,72 l
Hướng dẫn giải:
Chọn A.
CH4 + 2O2 → CO2 + 2H2O
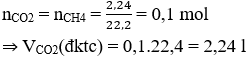
Câu 8: Có 2 bình khí khác nhau là CH4 và CO2. Để phân biệt các chất ta có thể dùng :
A. Dung dịch nước brom
B. Dung dịch nước vôi trong dư (Ca(OH)2)
C. Một kim loại
D. Tất cả đều đúng
Hướng dẫn giải:
Chọn B.
Sục hai khí trên vào dung dịch nước vôi trong dư, bình nào làm nước vôi trong vẩn đục là khí CO2. Bình còn lại không làm nước vôi trong vẩn đục là khí CH4
Câu 9: Đốt cháy hoàn toàn m g ankan A trong không khí thì thu được 0,224 lít khí CO2 (đktc) và 0,36 g H2O. Tìm CTPT của A, biết khối lượng oxi phản ứng là 0,64 g.
A. CH4
B. C2H6
C. C3H8
D. C4H10
Hướng dẫn giải:
Chọn A.