CH3COONa ra CH4 l CH3COONa + NaOH → CH4 + Na2CO3
Sinx.edu.vn xin giới thiệu phương trình CH3COONa + NaOH → CH4 + Na2CO3 là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng CH3COONa + NaOH → CH4 + Na2CO3
1. Phương trình điều chế Metan trong phòng thí nghiệm
CH3COONa + NaOH → CH4 + Na2CO3
2. Điều kiện phản ứng CH3COONa ra CH4
Nhiệt độ: nhiệt độ
Xúc tác: CaO
3. Hiện tượng nhận biết phản ứng
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm CH4 (metan) (trạng thái: khí), Na2CO3 (natri cacbonat), được sinh ra
Hoặc bạn phải quan sát chất tham gia CH3COONa (natri acetat), NaOH (natri hidroxit), biến mất.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của CH3COONa (Natri axetat)
CH3COONa tham gia được phản ứng nhiệt phân, CH3COONa khử caboxyl để tạo thành metan trong điều kiện cưỡng bức (nhiệt phân với sự hiện diện của natri hydroxit).
4.2. Bản chất của NaOH (Natri hidroxit)
NaOH là một bazo mạnh phản ứng nhiệt phân với CH3COONa.
5. Cách tiến hành phản ứng điều chế CH4 trong phòng thí nghiệm
Metan được điều chế bằng cách đun nóng natri axetat khan với hỗn hợp vôi tôi xút.
6. Tính chất hóa học của CH3COONa
a. Natri axetat có thể dùng để điều chế este với một alkyl halua như là brometan:
CH3COO–Na+ + Br-CH2-CH3 → CH3COOCH2–CH3 + NaBr
b. Phản ứng nhiệt phân
Natri axetat khử caboxyl để tạo thành metan trong điều kiện cưỡng bức (nhiệt phân với sự hiện diện của natri hydroxit):
CH3COONa + NaOH → CH4 + Na2CO3
7. Tính chất hóa học của NaOH
NaOH Là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
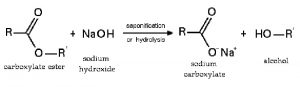
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
8. Điều chế Metan trong phòng thí nghiệm
Điều chế Metan CH4 trong phòng thí nghiệm.
8.1. Hóa chất và dụng cụ
Hóa chất: CH3COONa, NaOH, CaO, H2O
Dụng cụ: ống nghiệm, giá đỡ, chậu thủy tinh, nút cao su, ống dẫn khí bằng thủy tinh, đèn cồn.
8.2. Phương pháp thu khí metan
Sử dụng phương pháp đẩy nước, vì metan là chất khí ít tan được trong nước.
8.3. Điều kiện xảy ra phản ứng.
Điều kiện đun nóng hỗn hợp, có xúc tác CaO.
8.4. Cách thực hiện thí nghiệm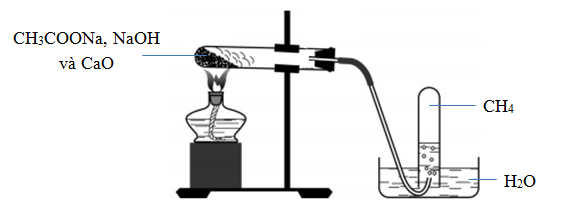
8.5. Phương trình điều chế CH4 trong phòng thí nghiệm
CH3COONa + NaOH → CH4 + Na2CO3
9. Ứng dụng của metan
Metan là một trong những nhiên liệu vô cùng quan trọng. Nếu so với việc đốt cháy than đá thì đốt cháy metan sẽ sinh ra ít CO2 trên mỗi đơn vị nhiệt giải phóng.
Metan thường được sử dụng làm nhiên liệu cho các lò nướng, nhà cửa, máy nước nóng, lò nung, xe ôtô… Nó đốt cháy oxy để tạo ra nhiệt.
Metan dưới dạng khí tự nhiên nén được sử dụng làm nhiên liệu cho xe cộ và được đánh giá là thân thiện với môi trường.
Khí CH4 có vai trò quan trọng trong việc phát điện bằng cách đốt nó như một nhiên liệu trong tuabin khí. Hoặc máy phát điện hơi nước. Vì vậy ở nhiều nơi khí metan được biết đến là một loại khí thiên nhiên dùng để sưởi ấm và nấu ăn.
10. Bạn có biết
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ CH3COONa (natri acetat) ra CH4 (metan)
11. Câu hỏi vận dụng
Câu 1: Phản ứng hóa học đặc trưng của metan là:
A. Phản ứng thế.
B. Phản ứng cộng.
C. Phản ứng oxi hóa – khử.
D. Phản ứng phân hủy.
Lời giải:
Đáp án: A
Câu 2. Các tính chất vật lí cơ bản của metan là:
A. Chất lỏng, không màu, tan nhiều tron nước
B. Chất khí, không màu, không mùi, nhẹ hơn không khí, tan ít trong nước
C. Chất khí không màu, tan nhiều trong nước
D. Chất khí không màu, không mùi, nặng hơn không khí, tan ít trong nước
Lời giải:
Đáp án: B
Giải thích:
Các tính chất vật lí cơ bản của metan là:
B. Chất khí, không màu, không mùi, nhẹ hơn không khí, tan ít trong nước
Câu 3: Trong phòng thí nghiệm có thể thu khí CH4 bằng cách:
A. Đẩy không khí (ngửa bình)
B. Đẩy axit
C. Đẩy nước (úp bình)
D. Đẩy bazo
Lời giải:
Đáp án: C
Giải thích:
CH4 không tan trong nước nên cần phải thu bằng phương pháp đẩy nước.
Câu 4: Để chứng minh sản phẩm của phản ứng cháy giữa metan và oxi có tạo thành khí cacbonic hay không ta cho vào ống nghiệm hóa chất nào say đây?
A. Nước cất
B. Nước vôi trong
C. Nước muối
D. Thuốc tím
Lời giải:
Đáp án: B
Giải thích:
Khi cho nước vôi trong Ca(OH)2 vào ống nghiệm thấy dung dịch bị vẩn đục chứng tỏ có khí CO2. CO2 phản ứng với Ca(OH)2 tạo kết tủa làm dung dịch bị vẩn đục.
Câu 5: Điều kiện để phản ứng giữa Metan và Clo xảy ra là:
A. Có bột sắt làm xúc tác
B. Có axit làm xúc tác
C. Có nhiệt độ
D. Có ánh sáng
Lời giải:
Đáp án: D
Giải thích:
Điều kiện để phản ứng giữa Metan và Clo xảy ra là:
Có ánh sáng
Câu 6: Dẫn khí metan và khí clo vào ống nghiệm, đặt ngoài ánh sáng. Sau đó, đưa mảnh giấy quỳ tím ẩm vào ống nghiệm. Hiện tượng quan sát được là:
A. Quỳ tím chuyển thành màu xanh
B. Quỳ tím bị mất màu
C. Quỳ tím chuyển thành màu đỏ
D. Quỳ tím không đổi màu
Lời giải:
Đáp án: C
Câu 7: Đốt cháy hoàn toàn 3,4 gam hỗ hợp CH4 và H2thì thu được 11,2 lít hơi H2O (đktc). Thành phần phần trăm theo khối lượng của mỗi khí trong hỗn hợp ban đầu là:
A. 90% CH4 và 10% H2
B. 60% CH4 và 40% H2
C. 94,12% CH4 và 5,88% H2
D. 91,12% CH4 và 8,88% H2
Lời giải:
Đáp án: C
Giải thích:
nH2O = 11,2/22,4 = 0,5 mol
CH4 + 2O2 CO2+ 2H2O
x------------------------>2x
2H2 + O2 2H2O
y----------------->y
Ta có:
16x + 2y = 3,42
x + y = 0,5
x = 0,2 mol
y = 0,1 mol
=> %CH4 = (0,2.16)/3,4.100%= 94,12 %
=>%H2 = 100 % - 94,12% = 5,88%
Câu 8. Khi clo hóa một ankan có công thức phân tử C6H14, người ta chỉ thu được 2 sản phẩm thế monoclo. Danh pháp IUPAC của ankan đó là :
A.2,2-đimetylbutan.
B.2-metylpentan.
C.n-hexan.
D.2,3-đimetylbutan.
Lời giải:
Đáp án: D
Giải thích:
Viết đồng phân ankan
Xét các vị trí thế clo của mỗi đồng phân
Vì clo hóa một ankan có công thức phân tử C6H14, chỉ thu được 2 sản phẩm thế monoclo
=> Danh pháp IUPAC của ankan
Câu 9. Các tính chất vật lí cơ bản của metan là:
A. Chất lỏng, không màu, tan nhiều tron nước
B. Chất khí, không màu, không mùi, nhẹ hơn không khí, tan ít trong nước
C. Chất khí không màu, tan nhiều trong nước
D. Chất khí không màu, không mùi, nặng hơn không khí, tan ít trong nước
Lời giải:
Đáp án: B
Câu 10. Chọn phát biểu đúng? Chọn phát biểu đúng?
A. Chất béo là trieste của glixerol với axit.
B. Chất béo là triete của glixerol với axit vô cơ.
C. Chất béo là trieste của glixe rol với axit béo
D. Chất béo là trieste của ancol với a xit béo.
Lời giải:
Đáp án: C
Câu 11. Cho dung dịch axit axetic nồng độ a% tác dụng vừa đủ với dung dịch NaOH nồng độ 20%, thu được dung dịch muối có nồng độ 20,5%. Hãy tính a.
A. 15%
B. 20%
C. 25%
D. 30%
Lời giải:
Đáp án: D
Giải thích:
Bài toán dạng này ta sẽ quy ban đầu số mol của NaOH là 1 (mol)
Phương trình hóa học: CH3COOH + NaOH → CH3COONa + H2O
Theo phương trình phản ứng: nCH3COOH= nCH3COONa = nNaOH= 1(mol)
=>mdd NaOH= (1×40)/20%.100% = 200 gam
mddCH3COOH = (1× 60)/a%.100% = 6000/a gam
mddsau = (1×82)/20,5%.100% = 400 (g)
Mà mddsau = mddCH3COOH + mddNaOH
=> 400 = 6000/a + 200
⇒ 200 = 6000/a ⇒ a = 30%
Câu 12. Cho các chất sau: ZnO, Na2SO4, NaOH, K2CO3, Ag, Fe. Số chất có thể tác dụng với dung dịch axit axetic là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án: D
Giải thích:
Các chất có thể tác dụng với axit axetic là: ZnO, NaOH, K2CO3, Fe.
2CH3COOH + ZnO → (CH3COO)2Zn + 2H2O
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O
2CH3COOH + Fe → (CH3COO)2Fe + H2