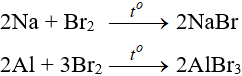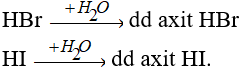C2H4 ra C2H4Br2 l C2H4 + Br2 → C2H4Br2
Sinx.edu.vn xin giới thiệu phương trình C2H4 + Br2 → C2H4Br2 là phản ứng cộng. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Nội dung bài viết
Xem thêm »
Phản ứng C2H4 + Br2 → C2H4Br2
1. Phương trình phản ứng cộng của etilen với dung dịch Brom
CH2 = CH2 + Br2 → Br - CH2 - CH2 - Br
Etilen Brom Đi brommetan
C2H4 + Br2 → C2H4Br2
2. Điều kiện phản ứng
- Không có
3. Hiện tượng nhận biết etilen với dung dịch Brom
Dung dịch brom đã bị mất mùa.
4. Bản chất của C2H4 (Etilen) trong phản ứng
Do liên kết kém bền trong liên kết đôi CH2=CH2 bị đứt ra nên mỗi phân tử etilen đã kết hợp thêm một phân tử brom.
5. Tính chất của etilen
5.1. Tính chất hoá học
a. Phản ứng oxi hóa
Khi etilen cháy hoàn toàn tạo ra CO2cùng H2O và phản ứng tỏa nhiều nhiệt
C2H4 + 3O2 → 2CO2 + 2H2O
b. Phản ứng cộng
Tác dụng với dung dịch brom (làm đổi màu dung dịch Br, mất màu)
C2H4 + Br2 → C2H4Br2
Phản ứng với clo
CH2 = CH2 + Cl2 → CH2=CH2Cl – HCl
Phản ứng cộng hidro
C2H4+ H2 → C2H6
Phản ứng cộng axit
CH2= CH2 + HCl (khí) → CH3CH2Cl
C2H4+ HBr → C2H5Br
Phản ứng cộng nước (có điều kiện nhiệt độ và sự xúc tác của axit)
C2H4 + H2O → C2H5OH
c. Phản ứng trùng hợp
Ở trong điều kiện thích hợp, liên kết kém bền trong phân tử etilen bị đứt ra dẫn đến hiện tượng các phân tử etilen kết hợp lại với nhau tạo ra một chất có phân tử lượng rất lớn được gọi là polime.
…+ CH2 = CH2 + CH2= CH2 +… → … – CH2– CH2– CH2– CH2 – …
Tham khảo thêm các phản ứng hóa học khác của C2H4:
3C2H4+ 2KMnO4 + 4H2O → 3C2H6O2 + 2KOH + 2MnO2
C2H4 + 2Na → C2H4Na2
5.2. Tính chất vật lí của etilen
- Nhìn vào công thức cấu tạo của Etilen, có thể thấy đây là chất khí, không màu, không mùi, nhẹ hơn không khí (d= 28/29), ít tan trong nước. Etilen cũng rất dễ bắt cháy và có mùi ngọt nhẹ của xạ hương.
- Etilen tan ít trong nước nhưng tan nhiều trong ete và một số dung môi hữu cơ.
- Để nhận biết khí etilen, người ta dùng các phương pháp:
Dẫn khí etilen qua dung dịch brom (dung dịch có màu cam), quan sát thấy dung dịch brom bị mất màu.
Dẫn khí etilen qua dung dịch kali pemanganat, quan sát thấy dung dịch kali pemanganat bị mất màu.
6. Tính chất hóa học của Br2
6.1. Tính chất hoá học
a. Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
b. Tác dụng với hidro
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
c. Tính khử của Br2, HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
6.2. Tính chất vật lí
- Brom là chất lỏng màu đỏ nâu, mùi khó chịu, dễ bay hơi, độc.
- Brom Là chất ôxi hóa yếu hơn clo.
7. Cách tiến hành thí nghiệm C2H4 ra C2H4Br2
Dẫn khí etilen qua dung dịch brom có màu da cam.
8. Bạn có biết
- Như vậy, liên kết kém bền trong liên kết đôi bị đứt ra và mỗi phân tử etilen đã kết hợp thêm một phân tử brom. Phản ứng trên được gọi là phản ứng cộng.
9. Bài tập vận dụng
Câu 1. Khí metan có lẫn một lượng nhỏ khí etilen. Để thu được metan tinh khiết, ta dẫn hỗn hợp khí qua
A. dung dịch brom.
B. dung dịch phenolphtalein.
C. dung dịch axit clohidric.
D. dung dịch nước vôi trong.
Lời giải:
Đáp án: A
Giải thích:
Dẫn hỗn hợp khí qua dung dịch brom. Khí etilen phản ứng với brom bị giữ lại trong dung dịch.
CH2 = CH2 + Br2 → Br – CH2 – CH2 – Br.
Khí metan không phản ứng thoát ra khỏi dung dịch, thu được metan tinh khiết.
Câu 2. Khi dẫn khí etilen vào dung dịch Brom dư đựng trong ống nghiệm có quan sát thấy
A. màu của dung dịch brom nhạt dần, có chất kết tủa
B. màu của dung dịch brom nhạt dần, có chất lỏng không tan chìm xuống đáy ống nghiệm
C. màu của dung dịch brom nhạt dần, có khí thoát ra
D. màu của dung dịch brom không thay đổi
Lời giải:
Đáp án: B
Giải thích:
Khi dẫn khí etilen vào dung dịch Brom dư đựng trong ống nghiệm có quan sát thấymàu của dung dịch brom nhạt dần, có chất lỏng không tan chìm xuống đáy ống nghiệm
Câu 3. Phản ứng đặc trưng của khí etilen là
A. phản ứng cháy.
B. phản ứng thế.
C. phản ứng cộng.
D. phản ứng phân hủy.
Lời giải:
Đáp án: C
Câu 4. Trong phòng thí nghiệm, người ta đun rượu etylic với chất xúc tác là H2SO4 đặc, ở nhiệt độ 170°C để điều chế khí X. Khí X là
A. Cl2.
B. CH4.
C. C2H4.
D. C2H2.
Lời giải:
Đáp án: C
A. 11,2 lít.
B. 16,8 lít.
C. 22,4 lít.
D. 33,6 lít.
Lời giải:
Đáp án: B
Câu 6. Trùng hợp 1 mol etilen (với hiệu suất 100 %) ở điều kiện thích hợp thì thu được khối lượng polietilen là
A. 7 gam.
B. 14 gam.
C. 28 gam.
D. 56 gam.
Lời giải:
Đáp án: C
Câu 7. Etilen có các tính chất hóa học sau:
A. Tham gia phản ứng cộng, phản ứng trùng hợp, phản ứng với thuốc tím và phản ứng cháy.
B. Chỉ tham gia phản ứng thế và phản ứng với dung dịch thuốc tím.
C. Chỉ tham gia phản ứng cháy.
D. Chỉ tham gia phản ứng cộng, phản ứng trùng hợp, không tham gia phản ứng cháy.
Lời giải:
Đáp án: A
Giải thích:
Etilen có các tính chất hóa học sau:
A. Tham gia phản ứng cộng, phản ứng trùng hợp, phản ứng với thuốc tím và phản ứng cháy.
Câu 8. Cho hỗn hợp X gồm metan, etilen và axetilen. Lấy 8,6 gam X tác dụng hết với dung dịch brom dư thì khối lượng brom phản ứng là 48 gam. Mặt khác, nếu cho 13,44 lít (ở đktc) hỗn hợp khí X tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được 36 gam kết tủa. Phần trăm thể tích của CH4 có trong X là
A. 40%.
B. 20%.
C. 25%
D. 50%
Lời giải:
Đáp án: D
Giải thích:
Trong 8,6g X chứa x mol C2H4; y mol C2H2; z mol CH4
mhh X= 28z + 26y + 16z = 8,6 (1)
nBr2 phản ứng = nπ trong X = nC2H4 + 2.nC2H2 => x + 2y = 0,3 (2)
C2H2 + 2AgNO3+ 2NH3 → C2Ag2 + 2NH4NO3
nC2Ag2 = 0,15 (mol) => nC2H2= 0,15 (mol)
=> %nC2H2 trong X = 0,15/0,6 = 25%
=> trong 8,6 gam X % số mol C2H2 cũng là 25% => y = 25%.(x + y + z) (3)
Từ (1), (2) và (3) => x = 0,1; y = 0,1; z = 0,2
==>%n CH4 trong X = 50%
Câu 9. Hỗn hợp khí X gồm H2 và C2H4 có tỉ khối so với He là 3,75. Dẫn X đi qua Ni đun nóng, thu được hỗn hợp khí Y có tỉ khối so với He là 5. Hiệu suất của phản ứng hidro hóa là?
A. 20%
B. 25%
C. 50%
D. 40%
Lời giải:
Đáp án: C
Giải thích:
Giả sử lấy 1 mol hỗn hợp X.
Gọi x, y lần lượt là số mol của H2, C2H4
Ta có theo giả sử
=> x + y = 1 (1)
MX= (28x + 2y)/(x + y) = 3,75.4 (2)
Từ (1) và (2) => x = y = 0,5 mol
Hiệu suất tính theo H2 hoặc C2H4 đều như nhau
Áp dụng công thức:
MX/MY = nY/nX=> nY = (nX.MX)/MY= (1.3,75.4)/5.4= 0,75
=> nH2 phản ứng = ngiảm = 1 – 0,75 = 0,25 mol
=> H = 0,25/0,5.100% = 50%
Câu 10. Chất nào sau đây làm mất màu dung dịch Brom
A. metylpropan
B. cacbon đioxit
C. butan
D. but-1-en
Lời giải:
Đáp án: D
Giải thích:
Những chất nào có liên kết π kém bền trong phân tử có khả năng làm mất màu dung dịch Br2.
(trừ liên kết pi trong vòng benzen).
Vậy but-1-en làm mất màu dung dịch brom.
Phương trình hóa học
CH2 = CH-CH2-CH3 + Br2 → CH2Br-CHBr-CH2-CH3