Mg + HNO3 → Mg(NO3)2 + NO2 + H2O | Mg ra Mg(NO3)2
Sinx.edu.vn xin giới thiệu phương trình Mg + HNO3 → Mg(NO3)2 + NO2 + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Mg + HNO3 → Mg(NO3)2 + NO2↑ + H2O
1. Phương trình phản ứng Mg tác dụng HNO3 đặc
Mg + 4HNO3 → Mg(NO3)2 + 2NO2↑ + 2H2O
Cách cân bằng phương trình phản ứng
Mg + HNO3 Mg(NO3)2 + NO2↑ + H2O
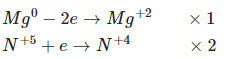
Phương trình hóa học: Mg + 4HNO3 → Mg(NO3)2 + 2NO2↑+ 2H2O
2. Điều kiện phản ứng Mg tác dụng với dung dịch HNO3 đặc
Nhiệt độ thường
3. Cách tiến hành phản ứng cho Mg tác dụng với dung dịch HNO3 đặc
Cho vào ống nghiệm 1,2 lá magie, nhỏ từ từ vừa đủ dung dịch HNO3 đặc.
4. Hiện tượng hóa học xảy ra giữa phản ứng Mg + HNO3 đặc
Lá magie Mg tan dần trong dung dịch axit HNO3 đặc và sinh ra khí có màu nâu đỏ.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Mg (Magie)
- Trong phản ứng trên Mg là chất khử.
- Mg là chất khử mạnh tác dụng với axit HCl, HNO3, H2SO4,..
5.2. Bản chất của HNO3 (Axit nitric)
- Trong phản ứng trên HNO3 là chất oxi hoá.
- Đây là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
6. Thông tin thêm: Axit nitric đặc tác dụng với kim loại
Axit nitric tác dụng với kim loại trừ Au và Pt tạo muối và nhiều sản phẩm oxi hóa khác nhau như NO2, NO, N2O ,N2, NH4NO3
Sản phẩm khử của N+5 sinh ra tùy thuộc vào độ mạnh yếu của kim loại và nồng độ của dung dịch axit, thông thường thì:
Dung dịch HNO3 đặc tác dụng với kim loại → NO2;
Dung dịch HNO3 loãng tác dụng với kim loại khử yếu (như: Cu, Pb, Ag,..) → NO;
Dung dịch HNO3 loãng tác dụng với kim loại mạnh (như: Al, Mg, Zn,...) thì N bị khử xuống mức
càng sâu → (N2, N2O, NH4NO3).
Cách phân biệt các khí sản phẩm sinh ra
- N2O là khí gây cười
- N2 không duy trì sự sống, sự cháy
- NO2 có màu nâu đỏ
- NO khí không màu nhưng bị oxit hóa thành NO2 màu nâu đỏ
NH4NO3 không sinh ra ở dạng khí, khi cho kiềm vào kim loại thấy có mùi khai amoniac NH3
NH4NO3 + NaOH → NaNO3 + NH3 + H2O
7. Tính chất hoá học của Mg
Magie là chất khử mạnh:
Mg → Mg2+ + 2e
7.1. Tác dụng với phi kim
Lưu ý: Do Mg có ái lực lớn với oxi: 2Mg + CO2 → MgO. Vì vậy không dùng tuyết cacbonic để dập tắt đám cháy Mg.
7.2. Tác dụng với axit
- Với dung dịch HCl và H2SO4 loãng:
Mg + H2SO4 → MgSO4 + H2
- Với dung dịch HNO3:
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3 H2O
7.3. Tác dụng với nước
Ở nhiệt độ thường, Mg hầu như không tác dụng với nước. Mg phản ứng chậm với nước nóng (do tạo thành hidroxit khó tan).
Mg + 2H2O → Mg(OH)2 + H2
7.4. Ứng dụng của Mg
Magie giúp giảm đau nửa đầu.
Magie giúp giảm huyết áp.
Magie giúp ngăn ngừa bệnh tiểu đường.
Magie giúp điều trị táo bón.
Magie được sử dụng để điều trị viêm loét dạ dày.
8. Tính chất hóa học của HNO3
- Axit nitric là một dung dịch nitrat hydro có công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, có tính oxy hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
- Axit nitric là một monoproton chỉ có một sự phân ly nên trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
- Axit nitric có tính chất của một axit bình thường nên nó làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric tác dụng với kim loại: Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
- Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
- Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
- Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
- Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có khả năng phá hủy nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể người.
9. Bài tập vận dụng liên quan
Câu 1. Có các chất sau: NaNO3, Ca(OH)2, K2CO3, HCl . Cặp chất nào có thể làm mềm nước cứng tạm thời :
A. NaNO3 và Ca(OH)2
B. Ca(OH)2 và K2CO3
C. Na2CO3 và HCl
D. NaNO3 và HCl
Lời giải:
Đáp án: B
Câu 2. Nhúng thanh Al vào dung dịch HNO3 loãng, không thấy có khí thoát ra. Kết luận nào sao đây là đúng:
A. Al không phản ứng với dung dịch HNO3 loãng
B. Al bị thụ động hóa trong dung dịch HNO3 loãng
C. Al phản ứng với HNO3 tạo ra muối amoni
D. Cả A và B đều đúng
Lời giải:
Đáp án: C
Al phản ứng với HNO3 tạo ra muối amoni
Câu 3. Hiện tượng nào xảy ra khi cho mảnh đồng kim loại vào dd HNO3 loãng
A. không có hiện tượng gì
B. dung dịch có màu xanh, H2 bay ra
C. dung dịch có màu xanh, có khí màu nâu bay ra
D. dung dịch có màu xanh, có khí không màu bay ra, bị hoá nâu trong không khí.
Lời giải:
Đáp án: D
Phương trình hóa học
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
dung dịch có màu xanh, có khí không màu bay ra, bị hoá nâu trong không khí.
Câu 4. Hòa tan 38,4 gam Cu vào dd HNO3 loãng dư, thu được V lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của V:
A. 13,44
B. 8,96
C. 4,48
D. 17,92
Lời giải:
Đáp án: B
Sử dụng bảo toàn e: nNO = 38,46438,464.2323 = 0,4 mol
=> V = 0,4.22,4 = 8,96 lít
Câu 5. Tiến hành thí nghiệm sau: thả một mẩu natri vào dung dịch chứa MgSO4.
Hiện tượng xảy ra được dự đoán như sau :
(a) Mẩu natri chìm xuống đáy dung dịch
(b) Kim loại magie màu trắng bạc thoát ra, lắng xuống đáy ống nghiệm.
(c) Dung dịch vẫn trong suốt.
(d) Có khí thoát ra.
Trong các hiện tượng trên, số hiện tượng xảy ra đúng như dự đoán là
A. 4
B. 2
C. 3
D. 1
Lời giải:
Đáp án: D
Hiện tượng phản ứng xảy ra: Mẩu Na phản ứng với nước, tan dần, có khí không màu thoát ra, dần dần xuất hiện kết tủa trắng.
Phương trình hóa học:
2Na + 2H2O → 2NaOH + H2↑
MgSO4 + 2NaOH → Mg(OH)2 ↓trắng + Na2SO4
Câu 6. Có thể phân biệt 3 dung dịch: KOH, HCl, H2SO4 (loãng) bằng một thuốc thử là
A. Giấy quỳ tím
B. Zn
C. Al
D. BaCO3
Lời giải:
Đáp án: D
Nếu chúng ta sử dụng quỳ tím chỉ có thể nhận biết được dung dịch NaOH
Dùng Zn, Al: không nhận biết được.
Dùng thuốc thử BaCO3
Cho BaCO3 lần lượt vào các dung dịch đã được đánh số thứ tự.
Dung dịch KOH không có hiện tượng
Dung dịch HCl có khí bay lên
Dung dịch H2SO4: có khí bay lên và kết tủa trắng
Phương trình phản ứng:
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
BaCO3 + H2SO4 → BaSO4↓ + CO2↑ + H2O
Câu 7. Một mẫu nước cứng có chứa thành phần các ion: Ca2+, Mg2+, HCO3-, Cl-, SO42-. Mẫu nước trên thuộc loại
A. nước cứng toàn phần.
B. nước cứng vĩnh cửu.
C. nước cứng tạm thời.
D. nước mềm.
Lời giải:
Đáp án: A
Câu 8. Một hỗn hợp gồm hai bột kim loại Mg và Al được chia thành hai phần bằng nhau:
Phần 1: cho tác dụng với HCl dư thu được 6,72 lít H2.
Phần 2: hoà tan hết trong HNO3 loãng dư thu được V lít một khí không màu, hoá nâu trong không khí . Biết các thể tích khí đều đo ở đktc, giá trị của V là
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 5,6 lít.
Lời giải:
Đáp án: C
Phần 1: nH2= 0,3 mol
Bảo toàn e: ne cho = ne nhận = 2.nH2= 0,6 mol
Vì số mol của Mg và Al ở 2 phần bằng nhau và Mg, Al phản ứng với HCl hay với HNO3 đều có số oxi hóa như nhau
=> ne cho (phần 2) = ne cho (phần 1) = 0,6mol
Phần 2: khí không màu, hóa nâu trong không khí là NO
Bảo toàn e: ne cho (phần 2) = 3.nNO => nNO = 0,630,63 = 0,2 mol
=> VNO = 0,2.22,4 = 4,48 lít
Câu 9. Phát biểu nào sau đây khi nhắc đến các loại nước là đúng?
A. Nước cứng là nước có chứa nhiều ion Ca2+, Mg2+.
B. Nước mềm là nước có chứa ít hoặc không chứa các ion Ca2+, Mg2+
C. Nước trong tự nhiên đều là nước cứng vì có chứa cation Ca2+, Mg2+.
D. Nước khoáng, nước lọc tự nhiên đều là nước cứng.
Lời giải:
Đáp án: A
Câu 10. Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư). Sau phản ứng sinh ra V lít khí NO2 (ở đktc, sản phẩm khử duy nhất). Tính thể tích khí sinh ra?
A. 6,72 lít
B. 13,44 lít
C. 3,36 lít
D. 10,08 lít
Lời giải:
Đáp án: A
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
nFe= 5,6565,656 = 0,1 mol
Theo phương trình
→ nNO2 = 3nFe=0,1 x 0,3= 0,3 mol
→ V = 0,3 x 22,4 = 6,72 lít
Câu 11. Dung dịch X gồm 5 ion: Mg2+, Ba2+, Ca2+, 0,2 mol Cl- và 0,4 mol NO3- . Thêm từ từ dung dịch Na2CO3 1M và dung dịch X đến khi được lượng kết tủa lớn nhất thì thể tích dung dịch Na2CO3 tối thiểu đã sử dụng là
A. 300ml
B. 250ml
C. 200ml
D. 150ml
Lời giải:
Đáp án: A
Gọi x, y, z lần lượt là số mol của Mg2+, Ba2+, Ca2+;
Áp dụng bảo toàn ion dung dịch X ta có: 2x + 2y + 2z = 0,2 + 0,4;
x + y + z = 0,3;
để thu được kết tủa là lớn nhất: thì số mol Na2CO3 = x + y + z = 0,3;
Thể tích Na2CO3 cần dùng là: V = 0,310,31 = 0,3 lít = 350 ml
Câu 12. Cho Ag vào 100ml dung dịch Mg(NO3)2 0,5M. Thêm tiếp vào hổn hợp 150 ml dung dịch H2SO4 2M. Khuấy dều và thêm nước vào đến dư cho phản ứng xảy ra hoàn toàn thấy Ag tan 1 phần và có khí bay ra. Thêm tiếp dung dịch NaBr đến dư vào dung dịch sau phản ứng thấy có kết tủa màu vàng. Khối lượng kết tủa vàng là:
A. 94 g
B. 112,8 g
C. 169,2 g
D. 56,4 g
Lời giải:
Đáp án: D
nNO3− = 2.nMg(NO3)2 =0,1 mol
nH+= 2nH2SO4 = 0,6 mol
4H+ + NO3- + 3e → NO + H2O
0,6 → 0,1 → 0,3
Ag + 1e → Ag+
0,3 → 0,3
Ag+ + Br− → AgBr
0,3 → 0,3
mAgBr= 0,3.188 = 56,4 gam
Câu 13. Cho hổn hợp X gồm 0,1 mol Cu; 0,1 mol Zn; 0,15 mol Al vào 500 ml dung dịch HCl. Phản ứng kết thúc thu được dung dịch B và hổn hợp rắn Y. Cho Y và dung dịch HNO3 có dư thu được 2,24 lít NO (đktc). Tìm nồng độ dung dịch HCl
A. 1,8M
B. 3M
C. 0,15M
D. 0,9M
Lời giải:
Đáp án: D
Bảo toàn e có 2nCu + 2nZn + 3nAl = nHCl + 3nNO2
⇒nHCl= 0,45 mol ⇒ CMHCl = 0,9 M
Câu 14. Cho 1,35 gam hỗn hợp gồm Cu, Mg, Al tác dụng hết với dung dịch HNO3 thu được hỗn hợp khí gồm 0,224 lít NO và 0,896 lít NO2 (không còn sản phẩm khử nào khác của N+5). Khối lượng muối trong dung dịch là. (Thể tích khí ở điều kiện tiêu chuẩn)
A. 10,08 gam.
B. 6,59 gam.
C. 5,69 gam.
D. 5,96 gam.
Lời giải:
Đáp án: C
Bảo toàn e: ne cho = ne nhận = 3.nNO + nNO2 = 3.0,01 + 0,04 = 0,07 mol
=> nNO3- (trong muối) = ne cho= 0,07 mol
=> mmuối = mkim loại + mNO3-= 1,35 + 0,07.62 = 5,69 gam
Câu 15. Hỗn hợp X chứa K2O, NH4Cl, KHCO3 và BaCl2 với số mol các chất bằng nhau. Cho hỗn hợp X vào nước dư và đun nóng. Các chất tan trong dung dịch thu được là:
A. KCl, KOH, BaCl2.
B. KCl, KOH.
C. KCl, KHCO3, NH4Cl, BaCl2.
D. KCl
Lời giải:
Đáp án: D
Phản ứng xảy ra khi hỗn hợp tác dụng với nước:
K2O + H2O → 2KOH
Các phản ứng xảy ra tiếp theo:
NH4Cl + KOH → NH3 + H2O + KCl
KHCO3+ KOH → K2CO3 + H2O
K2CO3 + BaCl2 → BaCO3+ KCl
Vậy sau phản ứng dung dịch còn lại KCl
Câu 16. Hòa tan hoàn toàn m gam Al bằng dung dịch HNO3 loãng, thu được 2,688 lít (đktc) hỗn hợp khí X gồm N2, N2O và dung dịch chứa 8m gam muối. Tỉ khối của X so với H2 bằng 18. Giá trị của m là
A. 21,60.
B. 17,28.
C. 10,80.
D. 18,90.
Lời giải:
Đáp án: C
Nhận thấy MX = (MN2 + MN2O)/2= 28+44228+442 = 36
=> nN2 = nN2O = 0,1220,122= 0,06 mol
Ta có:
mAl(NO3)3 = 213.m27m27 = 7,89m < 8m => trong muối có NH4NO3
Bảo toàn e: 3nAl= 10nN2 + 8nN2O + 8nNH4NO3
=>3.m27m27 = 10.0,06 + 8.0,06 + 8nNH4NO3
3.m27m27 = 1,08 + 8nNH4NO3
→ nNH4NO3 = m72m72 − 0,135
Khối lượng muối tạo thành: mmuối= mAl(NO3)3 + mNH4NO3
=> 8m = 213.m27m27+ 80.(m72m72– 0,135) => m = 10,8 gam
Câu 17. Nung 4,46 gam hỗn hợp A gồm các kim loại Fe, Al, Zn, Mg trong oxi, sau một thời gian thu được 5,42 gam hỗn hợp B. Hoà tan hoàn toàn B vào dung dịch HNO3 (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc). Số mol HNO3 đã phản ứng là
A. 0,12.
B. 0,16.
C. 0,18.
D. 0,36.
Lời giải:
Đáp án: D
Bảo toàn khối lượng: mX + mO pứ = mY
=> nO pứ = nO (oxit) = 0,06 mol
Y + HNO3 → nNO = 0,63 mol
Bảo toàn e: ne KL = ne ( oxi) + ne(NO) = 0,06.2 + 0,06.3 = 0,3 mol
Mà ne KL = nNO3 muối = 0,3 mol
=> nHNO3= nNO3 muối + nNO (Bảo toàn N) = 0,3 + 0,06 = 0,36 mol