FeCl3 + NaOH → Fe(OH)3 + NaCl | FeCl3 ra Fe(OH)3 | NaOH ra Fe(OH)3 | NaOH ra NaCl
Sinx.edu.vn xin giới thiệu phương trình FeCl3 + NaOH → Fe(OH)3 + NaCl là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng FeCl3 + NaOH → Fe(OH)3↓nâu đỏ + NaCl
1. Phương trình NaOH tác dụng với FeCl3
FeCl3 + 3NaOH → Fe(OH)3↓ (nâu đỏ) + 3NaCl
2. Điều kiện phản ứng FeCl3 ra Fe(OH)3
Nhiệt độ thường
3. Phương trình ion thu gọn FeCl3 + NaOH
Phương trình phân tử
FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓nâu đỏnâu đỏ
→ Phương trình ion rút gọn:
Fe3+ + 3OH- → Fe(OH)3⏐↓nâu đỏ ↓nâu đỏ
4. FeCl3 tác dụng NaOH có hiện tượng
Khi nhỏ dung dịch FeCl3 vào ống nghiệm đựng sẵn dung dịch NaOH. Màu vàng nâu của dung dịch Sắt III clorua FeCl3 nhạt dần và xuất hiện kết tủa nâu đỏ Sắt (III) hidroxit Fe(OH)3.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của FeCl3 (Sắt (III) clorua)
FeCl3 có tính chất hoá học của muối tác dụng với bazo tạo chất kết tủa màu trắng.
5.2. Bản chất của NaOH (Natri hidroxit)
NaOH là một bazo mạnh phản ứng với muối tạo muối mới và bazo mới.
6. Một số nội dung liên quan đến muối Sắt (III) clorua
6.1. Tính chất hóa học muối sắt (III) clorua
Muối sắt (III) clorua có tính oxi hoá. Tác dụng với sắt với phương trình phản ứng sau:
2FeCl3 + Fe → 3FeCl2
Tác dụng với kim loại Cu để tạo ra muối sắt II clorua và đồng clorua:
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Khi sục khí H2S vào sẽ có hiện tượng vẫn đục.
2FeCl3 + H2S → 2FeCl2+ 2HCl + S
Khi được cho vào dung dịch KI và benzen sẽ xảy ra hiện tượng dung dịch có màu tím.
2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2
6.2. Điều chế Muối sắt (III) clorua
Hóa chất này được điều chế trực tiếp từ phản ứng của Fe với chất oxi hóa mạnh như Cl2, HNO3, H2SO4 đặc nóng như sau:
2Fe + 3Cl2 → 2FeCl3
2Fe + 6H2O + 6NO2Cl ⟶ 3H2+ 6HNO3 + 2FeCl3
Fe + 4HCl + KNO3 ⟶ 2H2O + KCl + NO + FeCl3
- Điều chế từ hợp chất Fe(III) với axit HCl:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
FeS2 + 3HCl + 5HNO3 ⟶ 2H2O + 2H2SO4 + 5NO + FeCl3.
6.3. Ứng dụng của FeCl3
- Ứng dụng FeCl3 trong công nghệ xử lý nước thải
Giúp tạo bông bền và thô.
Nó cũng có thể sử dụng được cho nước có nồng độ muối cao, chính vì thế mà đây là hóa chất xử lý rác thải công nghiệp và nước thải đô thị được sử dụng phổ biến hiện nay.
Có tác dụng như keo lắng để làm nước được trong hơn, đặc biệt với phản ứng kết tủa thì nó còn giúp loại bỏ photphase.
- Ứng dụng FeCl3 trong phòng thí nghiệm
Là một chất xúc tác phản ứng như khử trùng bằng clo của các hợp chất thơm, sử dụng trong ngành thủ công mỹ nghệ của các chất thơm.
- Ứng dụng FeCl3 trong y học
FeCl3 được sử dụng làm chất làm se vết thương. Ngoài ra, FeCl3 còn có rất nhiều ứng dụng khác trong cuộc sống và công nghiệp.
7. Tính chất hoá học của NaOH
NaOH là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
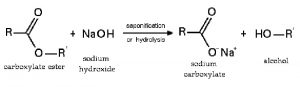
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
8. Bài tập vận dụng liên quan
Câu 1. Khi cho dung dịch NaOH phản ứng với dung dịch FeCl2 hiện tượng gì xảy ra:
A. Xuất hiện màu nâu đỏ
B. Xuất hiện màu trắng xanh
C. Xuất hiện màu nâu đỏ rồi chuyển sang màu trắng xanh
D. Xuất hiện màu trắng xanh rồi chuyển sang màu nâu đỏ
Lời giải:
Đáp án: D
Ban đầu tạo Fe(OH)2 có màu trắng xanh:
FeCl2 + 2NaOH → Fe(OH)2 ↓↓(trắng xanh) + 2NaCl
Sau đó Fe(OH)2 bị O2 (trong dung dịch và không khí) oxi hóa thành Fe(OH)3 có màu nâu đỏ:
Fe(OH)2+ 1414O2 + 1212H2O → Fe(OH)3 ↓↓(nâu đỏ)
Vậy hiện tượng là tạo kết tủa trắng xanh, sau đó chuyển nâu đỏ.
Câu 2. Cặp chất khi phản ứng với nhau tạo thành chất kết tủa trắng:
A. Ca(OH)2 và Na2SO3
B. NaOH và Na2SO3
C. KOH và NaNO3.
D. KOH và NaNO3.
Lời giải:
Đáp án: A
A. Thỏa mãn vì phản ứng được với nhau sinh ra kết tủa trắng.
Phương trình hóa học
Ca(OH)2 + Na2SO3 → CaSO3↓trắng + 2NaOH
B, C, D loại vì không xảy ra phản ứng
Câu 3. Cho bột Fe vào dung dịch AgNO3 dư, sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch gồm các chất tan:
A. Fe(NO3)2, Fe(NO3)3, AgNO3.
B. Fe(NO3)2, AgNO3.
C. Fe(NO3)3, AgNO3.
D. Fe(NO3)2, Fe(NO3)3.
Lời giải:
Đáp án: C
Fe + Ag+ → Fe2+ + Ag
Ag+ dư tiếp tục phản ứng với Fe2+
Fe2+ + Ag+ → Fe3+ + Ag
⇒ Dung dịch sau phản ứng gồm Fe(NO3)3 và AgNO3 dư.
Câu 4. Cho dung dịch FeCl3 tác dụng với NaOH tạo thành kết tủa có màu
A. nâu đỏ.
B. trắng.
C. xanh thẫm.
D. trắng xanh.
Lời giải:
Đáp án: D
Phương trình phản ứng
3NaOH + FeCl3 → 3NaCl + Fe(OH)3↓nâu đỏ
Cho dung dịch FeCl3 tác dụng với NaOH tạo thành kết tủa có màu nâu đỏ.
Câu 5. Chất phản ứng được với dung dịch NaOH tạo kết tủa nâu đỏ là:
A. CuSO4.
B. FeCl3.
C. MgCl2.
D. Fe(NO3)2.
Lời giải:
Đáp án: B
Câu 6. Dung dịch muối nào sau đây sẽ có phản ứng với dung dịch HCl khi đun nóng?
A. FeCl3
B. FeSO4
C. Fe(NO3)2
D. Fe(NO3)3
Lời giải:
Đáp án: C
Câu 7. Tiến hành bốn thí nghiệm sau :
Thí nghiệm 1: Nhúng thanh Fe vào dung dịch FeCl3
Thí nghiệm 2: Nhúng thanh Zn vào dung dịch CuSO4
Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3
Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl
Số trường hợp xuất hiện ăn mòn điện hoá là
A. 1.
B. 2.
C. 4.
D. 3.
Lời giải:
Đáp án: B
Thí nghiệm 1: Fe + 2FeCl3 → 3FeCl2
→ ăn mòn hóa học vì không hình thành 2 điện cực mới
Thí nghiệm 2:
Zn+ CuSO4: ăn mòn điện hóa vì hình thành 2 điện cực Zn và Cu.
Hai điện cực tiếp xúc với nhau và tiếp xúc với dung dịch điện li
Zn2+, Cu2+
Thí nghiệm 3: Cu + FeCl3 : ăn mòn hóa học vì không hình thành 2 điện cực mới
Cu + FeCl3 → CuCl2 + FeCl2
Thí nghiệm 4: Ăn mòn điện hóa vì có 2 kim loại tiếp xúc với nhau và cùng tiếp xúc với dung dịch chất điện li. Fe là cực (-), Cu là cực (+)
Tại cực (-) : Fe → Fe2++ 2e
Tại cực (+) : 2H+ + 2e → H2
Có 2 Thí nghiệm xảy ra ăn mòn điện hóa
Câu 8. Nung nóng 6,3 gam Fe ngoài không khí sau một thời gian thu được m gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4. Hỗn hợp này phản ứng hết với dung dịch H2SO4 đặc nóng (dư), thu được 2,1 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Tính m?
A. 15 gam
B. 9 gam
C. 18 gam
D. 7,5 gam
Lời giải:
Đáp án: D
Ta có, nFe = 0,1125 mol và nSO2 = 0,09375 mol
Quy hỗn hỗn hợp X về 2 nguyên tố Fe và O
Quá trình nhường: Fe0 → Fe+3 + 3e
Quá trình nhận e: O0 + 2e → O-2
S+6 + 2e → S+4
Áp dụng định luật bảo toàn electron ta có:
0,3375 = 2x + 0,1875 → x = 0,075
Mặt khác ta có: nên: m = 6,3 + 0,075. 16 = 7,5 (gam).
Câu 9. Cho 9,2 gam hỗn hợp X gồm Cu2S, CuS, FeS2 và FeS tác dụng hết với HNO3 (đặc nóng dư) thu được V lít khí chỉ có NO2 (ở đktc, sản phẩm khử duy nhất) và dung dịch Y. Cho toàn bộ Y vào một lượng dư dung dịch BaCl2, thu được 23,3 gam kết tủa, còn khi cho toàn bộ Y tác dụng với dung dịch NH3 dư thu được 5,35 gam kết tủa. Giá trị của V là
A. 38,08
B. 19,04
C. 24,64
D. 16,8
Lời giải:
Đáp án: B
Áp dụng bảo toàn nguyên tố ta co:
nS= nBaSO4 = 0,1 mol
nFe= nFe(OH)3 = 0,05 mol
→ nCu = 0,05 mol
Bảo toàn electron:
6nS + 3nFe + 2nCu = nNO2
→ nNO2 = 0,85 mol
→ V = 19,04 lít
Câu 10. Dung dịch FeSO4 có thể làm mất màu dung dịch nào sau đây?
A. Dung dịch thuốc tím trong môi trường H2SO4
B. Dung dịch K2Cr2O7 trong môi trường H2SO4
C. Dung dịch Br2
D. Tất cả các đáp án trên
Lời giải:
Đáp án: D
Các dung dịch KMnO4/ H2SO4; K2Cr2O7/ H2SO4; Br2 đều là các chất oxi hóa → Fe2+ sẽ có phản ứng oxi hóa khử làm mất màu các dung dịch trên
Phương trình hoá học đã cân bằng
Mất màu tím
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Mất màu da cam
2K2CrO7 + 18FeSO4+ 14H2SO4 → Cr2(SO4)3 + 2K2SO4+ 9Fe2(SO4)3 + 14H2O
Mất màu nâu đỏ
6FeSO4 + 3Br2 → 2Fe2(SO4)3 + 2FeBr3
Câu 11. Nung hỗn hợp gồm 0,3 mol Fe và 0,2 mol S cho đến khi kết thúc phản ứng thu được chất rắn X. Cho A tác dụng với dung dịch HCl dư, thu được khí Y. Tỉ khối của Y so với không khí là:
A. 0,8045
B. 0,7560
C. 0,7320
D. 0,9800
Lời giải:
Đáp án: A
Ta có:
n(Fe) phản ứng = n(S)= 0,2 mol
X gồm: Fe (dư 0,1) và FeS 0,2 → Khí: H2 (0,1) và H2S: 0,2
→M(Y) = 0,1.2+0,2.340,30,1.2+0,2.340,3 = 703703
→ d(Y/ kk) = 7032970329 = 0,8045
Câu 11. Cho ít bột Fe vào dung dịch AgNO3 dư. Kết thúc phản ứng được dung dịch X. Dung dịch X gồm muối:
A. Fe(NO3)2
B. Fe(NO3)2; AgNO3
C. Fe(NO3)3; AgNO3
D. Fe(NO3)2; Fe(NO3)3
Lời giải:
Đáp án: C
Cho một ít bột Fe vào AgNO3 dư:
Fe + 2AgNO3→ Fe(NO3)2 + 2Ag↓
Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag↓
→ Dung dịch X gồm Fe(NO3)3, AgNO3